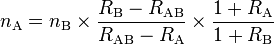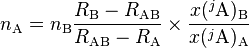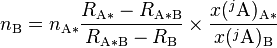Dilución de isótopos

Adición de un estándar alterado isotópicamente la muestra cambios de la composición isotópica natural del analito. Mediante la medición de la composición isotópica resultante, es posible calcular la cantidad de analito presente en la muestra.
Análisis de dilución de isótopos es un método de determinar la cantidad de sustancias químicas. En su concepción más simple, el método de dilución isotópica comprende la adición de cantidades conocidas de sustancias isotópicamente enriquecida de la muestra analizada. Mezcla del estándar isotópico con la muestra efectivamente "diluye" el enriquecimiento isotópico de la norma y esto forma la base para el método de dilución isotópica. Dilución de isótopos se clasifica como un método de normalización interna, porque la norma (isotópicamente enriquecida forma de analito) se agrega directamente a la muestra. Además, a diferencia de los métodos analíticos tradicionales que dependen de la intensidad de la señal, dilusión del isótopo emplea ratios de señal. Debido a ambas de estas ventajas, el método de dilución isotópica es considerado entre los métodos de medición química de la más alta situación metrológica.[1]
Contenido
- 1 Historia temprana
- 2 Ejemplo tutorial
- 3 Aplicaciones
- 4 Método de dilución simple
- 4.1 Composición óptima de la mezcla
- 5 Método de dilución doble
- 6 Método de dilución triple
- 7 Véase también
- 8 Referencias
- 9 Lectura adicional
Historia temprana

Aplicación analítica del método del radiotrazador es precursor de la dilusión del isótopo. Este método fue desarrollado a principios del siglo XX por George de Hevesy para el que fue galardonado con el Premio Nobel de química para 1943.
Una aplicación temprana de dilución de isótopos en forma de método de radiosonda fue determinación de la solubilidad del sulfuro de plomo y cromato de plomo en 1913 por George de Hevesy y Friedrich Adolf Paneth.[2] En la década de 1930, bioquímico de los E.E.U.U. David Rittenberg pionero en el uso de la dilusión del isótopo en bioquímica que permite estudios detallados del metabolismo celular.[3]
Ejemplo tutorial

Dilución isotópica puede explicarse con eficacia utilizando marca y recaptura método de la biología - un método comúnmente utilizado en ecología para estimar el tamaño de la población de peces.
Dilución isotópica puede compararse al método Lincoln-Petersen. Asumir que el número de peces en un estanque debe ser determinado. Cinco peces marcados se agregan al estanque durante la (primera) visitanB = 5). En la segunda visita, un número de peces se captura y se observa que la proporción de nativos de etiquetado es 10:1. Desde aquí, podemos estimar el número original de peces en el estanque, nA:
Esta es una vista simplificada de dilución de isótopos, sin embargo, ilustra las características más destacadas de la dilusión del isótopo. Una situación más compleja se presenta cuando la distinción entre peces etiquetados y sin etiqueta se convierte en borrosa. Esto puede ocurrir, por ejemplo, cuando el lago contiene un pequeño número de peces marcados de los anteriores experimentos de campo. En tal situación, puede emplearse la siguiente expresión:
donde RA es la proporción de los peces nativos a marcado en el lago, RB es la proporción de los peces nativos a marcado en el lote de nB marcado de peces que se agregan al estanque, y RAB es la relación de los peces nativos a etiquetado capturados durante la segunda visita.
Aplicaciones
Dilución isotópica se emplea casi exclusivamente con espectrometría de masas en aplicaciones donde se exige alta precisión. Por ejemplo, todos los institutos nacionales de Metrología dependen significativamente dilusión del isótopo al producir materiales de referencia certificados. Además de análisis de alta precisión, dilución de isótopos se aplica cuando se encuentra bajo recuperación del analito. Además del uso de isótopos estables, se pueden emplear isótopos radiactivos en dilución de isótopos que se encuentra a menudo en aplicaciones biomédicas.
Método de dilución simple
| Notación de dilución de isótopos | |
|---|---|
| Nombre | Símbolo |
| Analito | A |
| Estándar isotópico (Spike) | B |
| Analito + espiga | AB |
Considerar un analito natural rico en el isótopo iA (denotado como A) y el mismo analito, enriquecido en el isótopo jA (denotado como B). Luego, la mezcla obtenida es analizada para la composición isotópica del analito, RAB = n(iA)AB/n(jA)AB. Si la cantidad de la sustancia enriquecida isotópicamente (nB) es conocido, la cantidad de sustancia en la muestra (nA) puede obtenerse:[4]
Aquí, RA es el cociente de la cantidad de isótopo del analito natural, RA = n(iA)A/n(jA)A, RB es el cociente de la cantidad de isótopo del analito isotópicamente enriquecido, RB = n(iA)B/n(jA)B, RAB es el cociente de la cantidad de isótopo de la mezcla resultante, x(jA)A es la abundancia isotópica del isótopo menor en el analito natural, y x(jA)B es la abundancia isotópica del isótopo importante de analito isotópicamente enriquecido.
Para elementos con sólo dos isótopos estables, como el boro, cloro, o plata, la anterior ecuación de dilución única simplifica a lo siguiente:
En un típico cromatografía de gases Análisis, dilución isotópica puede disminuir la incertidumbre de los resultados de medición de 5% a 1%. También puede ser utilizado en espectrometría de masas (comúnmente conocida como espectrometría de masas dilución isotópica o IDMS), en que la relación isotópica puede ser determinada con precisión por lo general mejor que 0.25%.[5]
Composición óptima de la mezcla
De forma simplificada, la incertidumbre de los resultados de la medición depende de la medición de RAB:
Desde aquí, se obtiene la incertidumbre relativa de nA, ur(nA) = u(nA)/nA:
Incertidumbre relativa menor de nA corresponde a la condición cuando la primera derivada con respecto a la RAB es igual a cero. Además, es común en espectrometría de masas que u(RAB)/RAB es constante y por lo tanto, podemos reemplazar u(RAB) con RAB. Estas ideas se combinan para dar
Para resolver esta ecuación conduce a la composición óptima de la mezcla AB, es decir, la media geométrica entre las composiciones isotópicas de estándar (A) y spike (B):
Esta ecuación simplificada primero fue propuesta por De Bievre y Debus numéricamente[4] y más adelante por Riepe y Kaiser analíticamente.[6] Se ha observado que esta simple expresión es sólo una aproximación general y no tiene, por ejemplo, en presencia de las estadísticas de Poisson[7] o en presencia de correlación de relación isotópica fuerte señal.[8]
Método de dilución doble
Método de dilución solo requiere el conocimiento de la composición isotópica de la (analito isotópicamente enriquecidoRB) y la cantidad de analito enriquecido ()nB). Ambas de estas variables son difíciles de establecer puesto isotópicamente enriquecida con sustancias están generalmente disponibles en pequeñas cantidades de dudosa pureza. Como resultado, antes de realiza la dilución del isótopo en la muestra, la cantidad de analito enriquecido es comprobada previamente mediante dilución isotópica. Este paso preparatorio se llama la dilución isotópica inversa y se trata de un estándar del analito de composición isotópica natural (denotado como A *). Propuso por primera vez en la década de 1940[9] más desarrollado en la década de 1950,[10] dilución isotópica inversa sigue siendo un medio eficaz para caracterizar un material etiquetado.
| Notación de dilución de isótopos | |
|---|---|
| Nombre | Símbolo |
| Analito | A |
| Natural estándar | A* |
| Estándar isotópico (Spike) | B |
| Analito + espiga | AB |
| Estándar + punto | A * B |
Invertir el análisis de dilución de isótopos del analito enriquecido:
Análisis de dilución de isótopos del analito:
Desde la composición isotópica del A y A * son idénticos, la combinación de estas dos expresiones elimina la necesidad de medir la cantidad de los agregados (estándar enriquecidonB):
Método de dilución doble puede ser diseñado tales que la composición isotópica de las dos mezclas, A+B y A * + B, es idéntica, es decir, RAB = RA * B. Esta condición de coincidencia exacta dilusión del isótopo doble simplifica significativamente la ecuación anterior:[11]
Método de dilución triple
Para evitar la contaminación de la espectrómetro de masas con la espiga isotópicamente enriquecido, una mezcla adicional de la norma primaria (A *) y el punto (B) se puede medir en vez de medir directamente el spike enriquecido (B). Este enfoque fue primero presentado en la década de 1970 y desarrollado en el año 2002.[12]
Véase también
- Adición estándar
- Estándar interno
- Espectrometría de masas
- Marca y recaptura
- Índice de Lincoln
Referencias
- ^ M.J.T. Milton, R. I. Wielgosz (2000). «Incertidumbre en SI-trazabilidad mediciones de cantidad de sustancia por espectrometría de masas de dilución de isótopos». METROLOGIA 37 (3): 199 – 206. doi:10.1088/0026-1394/37/3/3.
- ^ G. V. Hevesy, F. Paneth (1913). "Die Löslichkeit des Bleisulfids und Bleichromats". Z. Anorg. Chem. 82 (1): 323-328. doi:10.1002/zaac.19130820125.
- ^ Dilución de isótopos — Memorias biográficas de la Academia Nacional de Ciencias
- ^ a b P. J. De Bievre, G. H. Debus (1965). "Análisis de dilución isotópica espectrometría de masa precisión". Nucl. Instr. Meth. 32 (2): 224-228. doi:10.1016/0029-554 X (65) 90516-1.
- ^ Publicación de EPA SW-846, "Métodos de ensayo para evaluar residuos sólidos, métodos físicos/químicos", disponible en https://www.EPA.gov/epaoswer/hazwaste/test/sw846.htm. Ver método 6800, "Elemental y Speciated isótopo dilución espectrometría de masas", disponible en https://www.EPA.gov/epaoswer/hazwaste/test/pdfs/6800.pdf.
- ^ W. Riepe y w. Kaiser (1966). «Massenspektrometrische Spurenanalyse von calcio, estroncio y bario en Natriumazid durch Isotopenverdünnungstechnik». Anal. Bioanal. Chem. 223 (5): 321-335. doi:10.1007/BF00513462.
- ^ R. Hoelzl, C. Hoelzl, L. Kotz y Fabry L. (1998). "La cantidad óptima de solución isotópica spike ultratraza análisis por espectrometría de masas de dilución de isótopos". Acreditadas. Torneo de Assur. 3 (5): 185-188. doi:10.1007/s007690050219.
- ^ J. Meija y Mester Z. (2007). "Señal de correlación en las mediciones de relación isotópica con espectrometría de masas: efectos en la propagación de la incertidumbre". Spectrochim. Acta B 62 (11): 1278-1284. doi:10.1007/BF00513462.
- ^ K. Bloch y H.S. Anker (1948). "Una extensión del método de dilución de isótopos". Ciencia 107 (2774): 228. doi:10.1126/Science.107.2774.228.
- ^ C. Rosenblum (1957). "Principios de análisis de dilución de isótopos". Anal. Chem. 29 (12): 1740-1744. doi:10.1021/ac60132a021.
- ^ A. Henrion (1994). "La reducción de errores sistemáticos en el análisis cuantitativo por espectrometría de dilución isotópica (IDMS): un método iterativo". Fres. J. Anal. Chem. 350 (12): 657 – 658. doi:10.1007/BF00323658.
- ^ M.J.T. Milton, J.A. Wang (2002). «Método de alta precisión para dilución isotópica espectrometría con aplicación a la medición de dióxido de carbono». Int J. Misa Spectrom. 218:: 63 – 73. doi:10.1016/S1387-3806 (02) 00663-2.
Lectura adicional
- Sargent (ed.), Mike; Harte (ed.), Rita; Harrington (ed.), Chris (2002). Directrices para el logro de alta precisión en espectrometría de masas de dilución isotópica (IDMS). Real Sociedad de química. p. 58. ISBN978-0-85404-418-4.
- Garcia-Alonso, J. Ignacio; Rodriguez-Gonzalez, Pablo (2013). Espectrometría de masas de dilución de isótopos. Real Sociedad de química. p. 453. ISBN978-1-84973-333-5.
|