Metabolismo humano del hierro

Metabolismo humano del hierro es el conjunto de reacciones químicas mantenimiento homeostasis humana de hierro tanto a nivel sistémico y celular. El control de este metal necesaria pero potencialmente tóxico es una parte importante de muchos aspectos de la salud y la enfermedad. Hematólogos han estado especialmente interesados en hierro sistémico metabolismo porque el hierro es esencial para células de sangre rojas, donde se encuentra la mayor parte del hierro del cuerpo humano. También es importante para las enfermedades de la comprensión de entender el metabolismo del hierro sobrecarga de hierro, tales como hemocromatosis hereditaria, y deficiencia de hierro, tales como anemia por deficiencia de hierro.
Contenido
- 1 Importancia de la regulación del hierro
- 1.1 Respiración celular
- 1.2 Transporte del oxígeno
- 1.3 Toxicidad
- 1.4 Protección bacteriana
- 2 Almacenes de hierro del cuerpo
- 3 Mecanismos de regulación del hierro
- 3.1 Regulación sistémica del hierro
- 3.1.1 Absorción de hierro en la dieta
- 3.1.2 Reciclaje de hierro y pérdida de
- 3.2 Regulación celular de hierro
- 3.2.1 Importación de hierro
- 3.2.2 El pool de hierro lábil
- 3.2.3 La agrupación de almacenamiento de hierro
- 3.2.4 Exportación de hierro
- 3.2.5 Control Traduccional del hierro celular
- 3.1 Regulación sistémica del hierro
- 4 Patología relacionada con el hierro
- 4.1 Deficiencia de hierro
- 4.2 Sobrecarga de hierro
- 5 Referencias
- 6 Lectura adicional
- 7 Acoplamientos externos
Importancia de la regulación del hierro

El hierro es un bioelement esencial para la mayoría de las formas de vida, de bacterias Para mamíferos. Su importancia radica en su capacidad para mediar la transferencia de electrones. En el estado ferroso, el hierro actúa como un donante del electrón, mientras que en el estado férrico actúa como un aceptador de. Así, el hierro juega un papel vital la Catálisis de reacciones enzimáticas que involucran a transferencia de electrones (reducción y oxidación, redox). Las proteínas pueden contener hierro como parte de diferentes cofactores, tales como racimos del hierro-sulfuro (Fe-S) y heme grupos, los cuales son ensamblados en mitocondrias.
Respiración celular
Las células humanas necesitan hierro para obtener energía como ATP de un proceso conocido como respiración celular, más específicamente de fosforilación oxidativa en el mitocondrial cristae. Hierro está presente en los racimos del hierro-sulfuro y grupos hemo de la cadena de transporte de electrones las proteínas que generan un gradiente del protón que permite Sintasa de ATP para sintetizar ATP (chemiosmosis).
Los grupos hemo son parte de hemoglobina, una proteína que se encuentra en los glóbulos rojos que sirve para transportar el oxígeno desde los pulmones a los tejidos. Grupos hemo están también presentes en mioglobina almacenar y difundir oxígeno en las células musculares.
Transporte del oxígeno
El cuerpo humano necesita hierro para el transporte de oxígeno. Oxígeno (O2) es necesaria para el funcionamiento y supervivencia de casi todos los tipos de célula (maduros eritrocitos siendo una excepción). Oxígeno es transportado desde los pulmones al resto del cuerpo a la heme Grupo de hemoglobina en los eritrocitos. En las células de los músculos, se une el hierro mioglobina, que regula su liberación.
Toxicidad
Hierro también puede ser potencialmente tóxico. Su capacidad para donar y aceptar electrones significa que puede catalizar la conversión de peróxido de hidrógeno en radicales libres. Los radicales libres puede causar daños a una amplia variedad de estructuras celulares y en última instancia, matar a la célula.[1]
Hierro enlazado a proteínas o cofactores tales como heme es seguro. También hay prácticamente no hay iones de hierro verdaderamente libre en la célula, puesto que fácilmente forman complejos con moléculas orgánicas. Sin embargo, algunos de hierro intracelular está ligada a complejos de baja afinidad y se denomina hierro lábil o hierro "libre". Hierro en estos complejos puede causar daños como se describe anteriormente.[2]
Para evitar ese tipo de daño, toda forma de vida que utilizan hierro unen los átomos de hierro a proteínas. Este enlace permite a las células para beneficiarse de hierro limitando también su capacidad para hacer daño.[1][3] Las concentraciones de hierro lábil intracelular típico en las bacterias son 10-20 micromolar,[4] Aunque puede ser 10 veces mayores en ambiente anaerobio,[5] donde libre el radicales y especies reactivas de oxígeno son más escasos. En células de mamífero, las concentraciones de hierro lábil intracelular son típicamente más pequeñas de 1 micromolar, menos del 5% del total de hierro celular.[2]
Protección bacteriana

En respuesta a una infección bacteriana sistémica, el sistema inmunológico inicia un proceso conocido como retención de hierro. Si las bacterias tienen que sobrevivir, debe obtener hierro de su entorno. Las bacterias que causan enfermedades hacen esto de muchas maneras, incluyendo la liberación de moléculas de hierro llamadas sideróforos y luego reabsorción para recuperar el hierro, o hierro de barrido de la hemoglobina y transferrina. Más difícil tienen que trabajar para obtener hierro, el mayor un precio metabólico tienen que pagar. Esto significa que las bacterias hierro-privados reproducen más lentamente. Así que nuestro control de los niveles de hierro parece ser una defensa importante contra las infecciones bacterianas más; sin embargo hay algunas excepciones. TB causando que la bacteria puede residir dentro macrófagos que son un ambiente rico de hierro y Borrelia burgdorferi utiliza manganeso en lugar de hierro. Las personas con mayores cantidades de hierro, como las personas con hemocromatosis, son más susceptibles a la infección por algunas bacteria.[6]
Aunque este mecanismo es una respuesta elegante a la infección bacteriana a corto plazo, puede causar problemas cuando la inflamación dura más. Puesto que el hígado produce Hepcidina en respuesta a inflamatorio citoquinas, los niveles de Hepcidina pueden aumentar como resultado de fuentes no bacterianos de la inflamación, como infección viral, cáncer, enfermedades autoinmunes u otras enfermedades crónicas. Cuando esto ocurre, el secuestro de hierro parece ser la causa principal del síndrome de anemia de enfermedad crónica, en el cual no está disponible para producir bastantes células de sangre rojas que contienen hemoglobina suficiente hierro.[3]
Almacenes de hierro del cuerpo
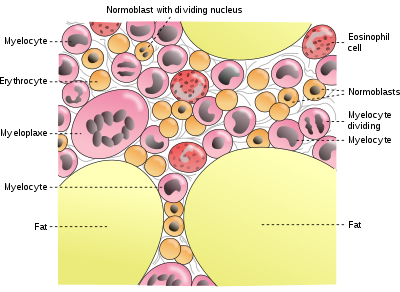
Personas más bien alimentadas en los países industrializados tienen 4 a 5 gramos de hierro en sus cuerpos. Esto, sobre 2,5 g se contiene en la hemoglobina necesaria para transportar oxígeno por la sangre, y el resto (aproximadamente 2 gramos en hombres adultos y algo menos en mujeres en edad fértil) se encuentra en ferritina complejos que están presentes en todas las células, pero es más común en la médula ósea, hígado, y bazo. Tiendas del hígado de ferritina son la principal fuente fisiológica de reserva de hierro en el cuerpo. Las reservas de hierro en los países industrializados tienden a ser menores en los niños y las mujeres en edad fértil que en los hombres y en los ancianos. Las mujeres que deben utilizar sus tiendas para compensar el hierro perdieron a través de menstruación, embarazo o lactancia tienen tiendas de cuerpo de hemoglobina no menor, que pueden consistir en 500 mg, o incluso menos.
Del hierro total del cuerpo contenido, sobre 400 mg se dedica a las proteínas celulares que utilizan hierro para procesos celulares importantes como almacenamiento de oxígeno (mioglobina) o realizar la producción de energía () reacciones redoxcitocromos). Una cantidad relativamente pequeña (3-4 mg) circula a través de la plasma, vinculado a la transferrina.[7] Debido a su toxicidad, hierro soluble libre se mantiene en baja concentración en el cuerpo.
Deficiencia de hierro afecta primero el almacenamiento de hierro en el cuerpo, y agotamiento de estas tiendas es probablemente relativamente no sintomático, aunque algunas vagas y síntomas no específicos se han asociado con él. Puesto que el hierro es requerido principalmente por hemoglobina, anemia por deficiencia de hierro es la principal manifestación clínica de deficiencia de hierro. Gente de deficiencia de hierro se sufren o mueren por daño a los órganos bien antes de que las células se quede sin el hierro necesario para los procesos intracelulares como el transporte de electrones.
Macrófagos de la sistema reticuloendotelial almacenar hierro como parte del proceso de ruptura y procesamiento de la hemoglobina de los glóbulos rojos ultraizquierdas. Hierro se almacena también como un pigmento llamado hemosiderina que es un depósito mal definido de proteína y hierro, creado por los macrófagos donde exceso de hierro está presente, ya sea local o sistémica por ejemplo entre las personas con hierro sobrecarga debido a las transfusiones y la destrucción de células sanguíneas frecuentes. Si la sobrecarga del hierro sistémico se corrige con el tiempo que la hemosiderina es reabsorbido lentamente por macrófagos.
Mecanismos de regulación del hierro
Homeostasis del hierro humano está regulada en dos niveles diferentes. Niveles de hierro sistémico están equilibrados por la absorción controlada de hierro en la dieta por enterocitos, las células que recubren el interior de la intestinosy la pérdida incontrolada de hierro del epitelio muda, sudor, lesiones y pérdida de sangre. Además, el hierro sistémico es continuamente reciclado. Niveles celulares de hierro son controlados diferentemente por diversos tipos celulares debido a la expresión de regulación particular hierro y proteínas de transporte.
Regulación sistémica del hierro

Absorción de hierro en la dieta
La absorción de hierro en la dieta es un proceso dinámico y variable. La cantidad de hierro absorbida en comparación con la cantidad ingerida es típicamente baja, pero puede variar de 5% a 35% dependiendo de circunstancias y el tipo de hierro. La eficiencia con la cual el hierro se absorbe varía dependiendo de la fuente. Generalmente las formas mejor absorbidas de hierro provienen de productos animales. Absorción de hierro en la dieta en forma de sal de hierro (como en la mayoría de los suplementos) varía un poco según la necesidad del cuerpo de hierro y es generalmente entre 10% y 20% de la ingesta de hierro. Absorción del hierro de productos de origen animal y algunos productos vegetales, es en forma de hierro heme y es más eficiente, permitiendo la absorción del 15% al 35% de la ingesta. Hierro hemo en los animales es de sangre y de proteínas que contienen hemo en la carne y las mitocondrias, mientras que en las plantas, el hierro heme está presente en las mitocondrias en todas las células que utilizan oxígeno para la respiración.
Como la mayoría de los nutrientes minerales, la mayor parte del hierro absorbido de digerir alimentos o suplementos se absorbe en el duodeno por enterocitos de la mucosa duodenal. Estas células tienen moléculas especiales que les permiten moverse de hierro en el cuerpo. Para ser absorbida, hierro en la dieta puede ser absorbido como parte de una proteína como la proteína heme o hierro debe estar en su Fe ferroso2+ forma. Una enzima reductasa férrica en el enterocito borde en cepillo, (duodenal cytochrome BDcytb), reduce el Fe férrico3+ a Fe2+.[8] Una proteína llamada (transportador de metales divalentes 1DMT1), que puede transportar varios divalentes metales a través de la membrana plasmática, luego transporta hierro en el enterocito membrana de la célula en la célula.
Estas células de revestimiento intestinal pueden entonces o bien almacenar el hierro como ferritina, que se logra por Fe3+ unirse a la apoferritina (en cuyo caso la plancha se deja el cuerpo cuando la célula muere y es desprendido en heces), o la célula puede liberarlo en el cuerpo a través de la única conocido exportador de hierro en los mamíferos, ferroportin. Hephaestin, un ferroxidase puede oxidar el Fe2+ a Fe3+ y se encuentra principalmente en el intestino, ayuda a ferroportin hierro de transferencia por el extremo basolateral de las células del intestino. Por el contrario, ferroportin postraduccional se reprime por Hepcidina, una hormona péptido de 25 aminoácidos. El cuerpo regula los niveles de hierro mediante la regulación de cada uno de estos pasos. Por ejemplo, los enterocitos sintetizan más Dcytb, DMT1 y ferroportin en respuesta a la anemia por deficiencia de hierro.[9] La absorción del hierro de la dieta es mayor en presencia de vitamina C y disminuida por el exceso de calcio, zinc o manganeso.[10][citación necesitada]
Tasa de absorción de hierro del cuerpo humano parece responder a una variedad de factores interdependientes, incluyendo el hierro total almacena el grado en que la médula está produciendo nuevos glóbulos rojos, la concentración de hemoglobina en la sangre y el contenido en oxígeno de la sangre. El cuerpo también absorbe menos hierro durante tiempos de inflamación, con el fin de privar a las bacterias del hierro. Recientes descubrimientos demuestran que la regulación de la Hepcidina de ferroportin es responsable del síndrome de la anemia de enfermedad crónica.
Reciclaje de hierro y pérdida de
La mayoría del hierro en el cuerpo es acumulado y reciclada por el sistema reticuloendotelial, que descompone los glóbulos rojos envejecidos. En contraste con la absorción de hierro y de reciclaje, no hay ningún mecanismo de regulación fisiológica para la excreción de hierro. Personas pierden una cantidad pequeña pero constante pérdida de sangre gastrointestinal, sudoración y por desprendimiento de las células de la piel y el mucosa guarnición de la tracto gastrointestinal. La cantidad total de pérdida para las personas sanas en el mundo desarrollado asciende a un promedio estimado de 1 mg un día para los hombres y 1.5-2 mg al día para las mujeres con períodos menstruales regulares. Las personas con infecciones parasitarias gastrointestinales, más frecuentes en los países en desarrollo, a menudo pierden más.[1] Aquellos que no pueden regular la absorción lo suficientemente bien como Obtén trastornos de sobrecarga de hierro. En estas enfermedades, la toxicidad de hierro comienza a abrumar la capacidad del cuerpo para atar y almacenarlo.[11]
Regulación celular de hierro
Importación de hierro
Mayoría de los tipos de la célula toma hierro principalmente por medio de endocitosis mediada por receptor por la receptor de transferrina 1 (TFR1), receptor de transferrina 2 (TFR2) y GAPDH. Hierro férrico enlazado a la transferrina es reconocida por el receptor de transferrina, precipitantes un cambio conformacional que provoca la endocitosis. Hierro después entra en el citoplasma de la endosome vía importador DMT1 después de ser reducido al estado ferroso por una reductasa familia subidas.[12][13][14]
Por otra parte, hierro puede entrar en la célula directamente a través de membrana plasmática Importadores de cationes divalentes DMT1 como ZIP14 (Zrt-Irt-como proteína 14). Otra vez, hierro entra en el citoplasma en el estado ferroso después de ser reducido en el espacio extracelular por una reductasa tales como STEAP2, STEAP3 (de eritrocitos), Dcytb (en enterocitos) y SDR2.[12]
El pool de hierro lábil
En el citoplasma, el hierro ferroso se encuentra en un estado soluble, chelatable, que constituye el pool de hierro lábil (~0.001 mM).[15] En esta piscina, hierro se cree que obligarse a compuestos de baja masa como péptidos, carboxilatos y fosfatos, aunque algunos podrían estar en una forma libre, hidratada (iones de Aqua).[15] Alternativamente, los iones de hierro podrían obligarse a proteínas especializadas, conocidas como metallochaperones.[16] el pool de hierro lábil es potencialmente tóxico debido a la capacidad del hierro para generar especies reactivas de oxígeno. Hierro de esta piscina se puede tomar por las mitocondrias a través mitoferrin para sintetizar Fe-S clusters y grupos hemo.[12]
La agrupación de almacenamiento de hierro
Hierro puede ser almacenado en la ferritina como hierro férrico debido a la ferroxidase actividad de la cadena pesada de la ferritina.[17] Ferritina disfuncional puede acumular como hemosiderina, que puede ser problemático en casos de sobrecarga de hierro.[18] La piscina de hierro ferritina almacenaje es mucho más grande que la piscina de hierro lábil, que van en la concentración de los 0.7m m a 3,6 mM.[15]
Exportación de hierro
Exportación de hierro ocurre en una variedad de tipos de células, incluyendo neuronas, eritrocitos, macrófagos y enterocitos. Estos últimos dos son especialmente importantes ya que ellos dependen de los niveles de hierro sistémico. Hay solamente un exportador de hierro conocido, ferroportin.[19] Transporta hierro ferroso fuera de la célula, generalmente con la ayuda de ceruloplasmina o hephaestin (sobre todo en los enterocitos), que oxida el hierro al estado férrico por lo que puede enlazar la ferritina en el medio extracelular.[12] Hepcidina produce la internalización de ferroportin, disminuyendo la exportación de hierro. Además, Hepcidina parece downregulate TFR1 y DMT1 mediante un mecanismo desconocido.[20] Otro jugador ayudar ferroportin en efectuar exportaciones de hierro celular es la orden más alta multifuncional[21] enzima glicolítica () gliceraldehído-3-fosfato deshidrogenasaGAPDH). Un post específico forma modificada isoforma de GAPDH es reclutado a la superficie de las células de hierro cargado donde recluta a apo-transferrina en proximidad cercana a ferroportin para rápidamente quelatar el hierro sacada.[22]
La expresión de la Hepcidina, que sólo ocurre en ciertos tipos de células tales como hepatocitos, está fuertemente controlada a nivel transcripcional y representa el vínculo entre la homeostasis del hierro celular y sistémica debido al rol de la Hepcidina como "gatekeeper" de la liberación de hierro desde los enterocitos en el resto del cuerpo.[12] Eritroblastos producir erythroferrone, una hormona que inhibe la Hepcidina y así aumenta la disponibilidad de hierro necesario para la síntesis de hemoglobina.[23]
Control Traduccional del hierro celular
A pesar de cierto control a nivel transcripcional, la regulación de los niveles celulares de hierro es controlada en última instancia a nivel traduccional por proteínas de unión a elemento sensible al hierro IRP1 e IRP2 especialmente.[24] Cuando los niveles de hierro son bajos, estas proteínas son capaces de enlazar a elementos de hierro-respuesta (IREs). IREs son tallo estructuras de bucle en las regiones sin traducir (UTRs) de ARNm.[12]
Ferritina y ferroportin contienen un IRE en sus 5' UTRs, de modo que bajo deficiencia de hierro su traducción es reprimido por IRP2, evitando la innecesaria síntesis de proteínas de almacenamiento y la perjudicial exportación de hierro. Por el contrario, TFR1 y algunas variantes de DMT1 contienen 3' UTR IREs, que atan la IRP2 bajo deficiencia de hierro, estabiliza el mRNA, que garantiza la síntesis de los importadores de hierro.[12]
Deficiencia de hierro
Deficiencia de hierro funcional o real puede resultar de una variedad de causas. Estas causas pueden agruparse en varias categorías:
- Mayor demanda de hierro, que no puede dar cabida a la dieta.
- Pérdida creciente de hierro (generalmente a través de la pérdida de sangre).
- Deficiencia nutricional. Esto puede resultar debido a una falta de hierro en la dieta o el consumo de alimentos que inhiben la absorción de hierro, incluyendo calcio, fitatos y taninos. Té negro empapado durante mucho tiempo tiene taninos altos.
- Incapacidad de absorber hierro: una causa común de deficiencia de hierro es el uso generalizado de reducción de medicamentos, el más fuerte de los cuales es inhibidores de la bomba de protones (IBP) como el ácido omeprazole.[citación necesitada]
- Daño a la mucosa intestinal. Ejemplos de causas de este tipo de daño incluyen la cirugía que implica el duodeno, o enfermedades como la De Crohn o Esprúe celíaco que seriamente reducir la superficie disponible para la absorción.
- Inflamación que lleva a la restricción de Hepcidina inducida sobre liberación de hierro desde los enterocitos (véase arriba).
Sobrecarga de hierro
El cuerpo es capaz de reducir sustancialmente la cantidad de hierro que absorbe a través de la mucosa. No parece ser capaz de cerrar completamente el proceso de transporte de hierro. También, en situaciones donde el exceso de hierro daña la intestinal forro sí mismo (por ejemplo, cuando los niños comen una gran cantidad de tabletas de hierro producido para consumo de adultos), incluso más hierro puede entrar en el torrente sanguíneo y causar un síndrome potencialmente mortal de la sobrecarga de hierro. Grandes cantidades de hierro libre en la circulación puede causar daños a las células críticas en el hígado, el corazón y otros órganos metabólicamente activos.
Toxicidad de hierro se produce cuando la cantidad de hierro en circulación excede la cantidad de transferrina para enlazarlo, pero el cuerpo es capaz de regular enérgicamente su absorción de hierro. Así, la toxicidad de hierro de la ingestión es generalmente el resultado de circunstancias extraordinarias como consumo excesivo de hierro tableta [25][1] en lugar de las variaciones en dieta. El tipo de toxicidad aguda por ingestión de hierro causa severo daño de la mucosa en el tracto gastrointestinal, entre otros problemas.
Toxicidad de hierro crónica es generalmente el resultado de síndromes de sobrecarga de hierro más crónicos asociados con enfermedades genéticas, las transfusiones repetidas o por otras causas. En tales casos las reservas de hierro de un adulto pueden llegar a 50 gramos (10 veces total normal cuerpo hierro) o más. Ejemplos clásicos de sobrecarga genética del hierro incluye hemocromatosis hereditaria (HH) y la enfermedad más severa hemocromatosis juvenil (JH) causado por mutaciones en cualquiera el gen RGMc gen, un miembro de una familia de molécula tres gene dirección repulsivo,[26] (también llamado hemojuvelin (HJV) y HFE2), Hemojuvelin, o el gen HAMP que codifica (un péptido regulador de hierro). Los mecanismos exactos de la mayor parte de las distintas formas de hemocromatosis adultos, que conforman la mayoría del hierro genética trastornos de sobrecarga, permanecen sin resolver. Así que mientras que los investigadores han podido identificar mutaciones genéticas causando varias variantes adultos de hemocromatosis, ahora deben dirigir su atención a la función normal de estos genes mutados.
Referencias
- ^ a b c Conrad ME, Umbreit JN (Abr de 2000). «Trastornos del metabolismo del hierro». El diario de Nueva Inglaterra de la medicina 342 (17): 1293-4. doi:10.1056/NEJM200004273421716. PMID10787338.
- ^ a b Kakhlon O, Cabantchik ZI (2002). "el pool de hierro lábil: caracterización, medición y participación en procesos celulares". Medicina y biología de radicales libres 33 (8): 1037-1046. doi:10.1016/s0891-5849 (02) 01006-7.
- ^ a b Andrews NC (diciembre de 1999). «Trastornos del metabolismo del hierro». El diario de Nueva Inglaterra de la medicina 341 (26): 1986-95. doi:10.1056/NEJM199912233412607. PMID10607817.
- ^ Yan Y, Waite-Cusic JG, Kuppusamy P, Yousef AE (enero de 2013). hierro libre intracelular y su papel potencial en la ultra alta presión-inducida por inactivación de Escherichia coli. Microbiología aplicada y ambiental 79 (2): 722-724. doi:10.1128/AEM.02202-12.
- ^ Yamamoto Y Fukui K N Koujin, combinación H, Kimura K, Kamio Y (2004). "Reglamento de la piscina intracelular hierro libre por RD ofrece tolerancia de oxígeno para Streptococcus mutans". Diario de la bacteriología 186 (18): 5997-6002. doi:10.1128/JB.186.18.5997-6002.2004.
- ^ Ganz T (agosto de 2003). "Hepcidin, un regulador clave del metabolismo del hierro y mediador de la anemia de la inflamación". Sangre 102 (3): 783 – 8. doi:10.1182/sangre-2003-03-0672. PMID12663437.
- ^ Camaschella C, Schrier SL (2011-11-07). "Regulación del balance de hierro". UpToDate. 2012-03-11.
- ^ McKie en el túmulo D, Latunde-Dada va, Rolfs A, Sager G, Mudaly E, Mudaly M, Richardson C, Barlow D, Bomford A, Peters TJ, Raja KB, S Shirali, Hediger MA, Farzaneh F, Simpson RJ (marzo de 2001). "Una regulada por el hierro férrico reductasa asociada con la absorción de hierro en la dieta". Ciencia 291 (5509): 1755 – 9. doi:10.1126/Science.1057206. PMID11230685.
- ^ Fleming RE, Bacon BR (abril de 2005). "Orquestación de la homeostasis de hierro". El diario de Nueva Inglaterra de la medicina 352 (17): 1741-4. doi:10.1056/NEJMp048363. PMID15858181.
- ^ "Hierro". Hoja de datos de extensión de Ohio State University. Universidad Estatal de Ohio. 25 de junio, 2012.
- ^ Schrier SL, Bacon BR (2011-11-07). "Síndromes de sobrecarga de hierro distintos de hemocromatosis hereditaria". UpToDate. 2012-03-11.
- ^ a b c d e f g Hentze MW, Muckenthaler MU, B Galy, Camaschella C (Jul de 2010). "dos al tango: regulación del metabolismo del hierro mamíferos". Célula 142 (1): 24 – 38. doi:10.1016/j.Cell.2010.06.028. PMID20603012.
- ^ Kumar S, Sheokand N, Mhadeshwar MA, Raje CI, Raje M (enero de 2012). "Caracterización de la deshidrogenasa de gliceraldehído-3-fosfato como un receptor de transferrina novela". La revista internacional de Bioquímica y biología celular 44 (1): 189 – 99. doi:10.1016/j.BioCel.2011.10.016. PMID22062951.
- ^ Sheokand N, Kumar S, Malhotra H, V Tillu, Raje CI, Raje M (Jun de 2013). "Secretada glyceraldehye-3-fosfato deshidrogenasa es un receptor de la transferrina autocrina multifuncional para la adquisición de hierro celular. Biochimica et Acta Scandinavica 1830 (6): 3816 – 27. doi:10.1016/j.bbagen.2013.03.019. PMID23541988.
- ^ a b c S de Yehuda, Mostofsky DI, EDS (2010). Deficiencia de hierro y sobrecarga de la biología básica para la medicina clínica. Nueva York, NY: Prensa de humana. p. 230.
- ^ LA de Finney, o ' Halloran TV (mayo de 2003). "Especiación de metales de transición en la célula: perspectivas de la química de los receptores del ion del metal". Ciencia 300 (5621): 931-6. doi:10.1126/Science.1085049. PMID12738850.
- ^ Arosio P, Levi S (agosto de 2002). «ferritina, homeostasis de hierro y daño oxidativo. Medicina y biología de radicales libres 33 (4): 457-63. doi:10.1016/s0891-5849 (02) 00842-0. PMID12160928.
- ^ Rouault TA, Cooperman S (Sep 2006). «Metabolismo del hierro del cerebro». Seminarios en neurología pediátrica 13 (3): 142 – 8. doi:10.1016/j.Spen.2006.08.002. PMID17101452.
- ^ Ganz T (Mar de 2005). "hierro celular: ferroportin es la única salida". Metabolismo de la célula 1 (3): 155 – 7. doi:10.1016/j.cmet.2005.02.005. PMID16054057.
- ^ Du F C Qian Qian ZM, Wu XM, Xie H, Yung WH, Ke Y (Jun de 2011). "Hepcidina inhibe directamente la expresión del receptor 1 de la transferrina en los astrocitos vía un camino del kinase A proteína AMP cíclico". Glia 59 (6): 936 – 45. doi:10.1002/glia.21166. PMID21438013.
- ^ Boradia, V. M.; Raje, M.; Raje, C. I., proteína moonlighting en metabolismo del hierro: gliceraldehído-3-fosfato deshidrogenasa (GAPDH). Bioquímica sociedad transacciones 2014, 42, (6), 1796-1801.
- ^ Sheokand N, H Malhotra, Kumar S, VA Tillu, Chauhan como, Raje CI, Raje M (Oct de 2014). "Moonlighting superficie celular GAPDH recluta apotransferrina a la salida de hierro del efecto de células de mamíferos". Diario de la ciencia celular 127 (19 Pt): 4279-91. doi:10.1242/JCS.154005. PMID25074810.
- ^ L Kautz, Jung G, Valore EV, Rivella S, Nemeth E, Ganz T (Jul de 2014). "Identificación de erythroferrone como eritroides regulador del metabolismo del hierro". Nature Genetics 46 (7): 678 – 84. doi:10.1038/ng.2996. PMC4104984. PMID24880340.
- ^ Muckenthaler MU, B Galy, Hentze MW (2008). homeostasis del hierro sistémico y la red reguladora de proteínas elemento hierro-regulador sensible al hierro (IRE/IRP). Revisión anual de la nutrición 28: 197-213. doi:10.1146/annurev.NUTR.28.061807.155521. PMID18489257.
- ^ Rudolph CD (2003). Pediatría de Rudolph. Nueva York: McGraw-Hill, publicación médica. División. ISBN0-07-112457-8.
- ^ Severyn CJ, Shinde U, Rotwein P (Sep 2009). Biología Molecular, genética y bioquímica de la familia de molécula guía repulsiva. El diario bioquímico 422 (3): 393-403. doi:10.1042/BJ20090978. PMID19698085.
Lectura adicional
- Andrews S, Norton I, AS Salunkhe, Goodluck H, Aly WS, Mourad-Agha H, Cornelis P (2013). "Capítulo 7, Control del metabolismo del hierro en bacterias". En el Banci L. La célula y Metalómica. Iones del metal en Ciencias de la vida 12. Springer. doi:10.1007/978-94-007-5561-1_7. ISBN978-94-007-5560-4. libro electrónico ISBN 978-94-007-5561-1 ISSN1559-0836 electrónica-ISSN1868-0402
- Andrews NC (mayo de 2004). "Anemia de la inflamación: el enlace de citoquinas Hepcidina". La revista de investigación clínica 113 (9): 1251-3. doi:10.1172/JCI21441. PMC398435. PMID15124013.
- Camaschella C (Dic de 2005). "Comprender la homeostasis del hierro a través de análisis genético de la hemocromatosis y trastornos relacionados". Sangre 106 (12): 3710 – 7. doi:10.1182/sangre-2005-05-1857. PMID16030190.
- Frazer DM, Anderson GJ (Oct de 2005). "Las importaciones de hierro. Absorción de hierro Intestinal de I. y su Reglamento. Diario americano de la fisiología. Fisiología gastrointestinal y del hígado 289 (4): G631 – 5. doi:10.1152/ajpgi.00220.2005. PMID16160078.
- Insel P, Ross D, McMahon K, Bernstein M (2011). "Hierro". Nutrición (4ª Ed.). Sudbury, Massachusetts: Jones y Bartlett Publishers. PP. 510-514. ISBN978-0-7637-7663-3. 25 de junio, 2012. ver especialmente pp. 513-514
- Lammi-Keef CJ, sofá SC, Philipson, Ed. (2008). "Diversificación de la dieta y modificación del hierro". Manual de nutrición y embarazo. Nutrición y salud. Totowa, New Jersey: Prensa de humana. págs. 350 – 351. doi:10.1007/978-1-59745-112-3. ISBN978-1-59745-112-3. 25 de junio, 2012.
- Panel en micronutrientes; Subcomités en los niveles de referencia superior de nutrientes y de la interpretación y usos de las ingestas de referencia en la dieta; Comité permanente de la evaluación científica de ingestas dietéticas de referencia (2001). "Hierro". Ingestas de referencia en la dieta para la vitamina A, vitamina K, arsénico, boro, cromo, cobre, yodo, hierro, manganeso, molibdeno, níquel, silicio, vanadio y Zinc. Washington, D.C: Food and Nutrition Board, Instituto de medicina. págs. 290-393. ISBN978-0-309-07279-3. 25 de junio, 2012.
- Reilly C (2004). "Hierro". Los metales traza nutricional. Oxford, Reino Unido y Ames, Iowa: Blackwell Publishing. págs. 35-81. ISBN1-4051-1040-6. 25 de junio, 2012.
Acoplamientos externos
- Una completa ficha de datos de NIH en hierro y la nutrición
- Instituto de trastornos de hierro: Un grupo sin fines de lucro relacionadas con trastornos de hierro; sitio tiene enlaces útiles e información sobre trastornos relacionados con el hierro.
- Un portal de aprendizaje médico interactivo sobre el metabolismo del hierro
- Información sobre hierro fuera del cuerpo
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||