Orexin
|
|
Este artículo se basa en referencias Para fuentes primarias. (Marzo de 2012) |
| Prepro-Orexina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
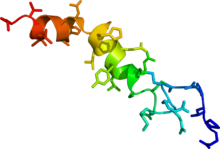
Fase de solución RMN estructura de orexin A basada en la PDB coordenadas
1R02.
|
|||||||||
| Identificadores | |||||||||
| Símbolo | Orexin | ||||||||
| Pfam | PF02072 | ||||||||
| InterPro | IPR001704 | ||||||||
| SCOP | 1cq0 | ||||||||
| SUPERFAMILIA | 1cq0 | ||||||||
| Superfamilia OPM | 154 | ||||||||
| Proteína OPM | 1wso | ||||||||
|
|||||||||
| precursor de neuropéptido Orexina (hipocretina) | |
|---|---|
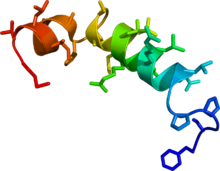
Fase de solución estructura NMR de orexin B basado en el PDB coordenadas
1CQ0.
|
|
| Identificadores | |
| Símbolo | HCRT |
| Símbolos Alt | PPOX, BUEY |
| Entrez | 3060 |
| HUGO | 4847 |
| OMIM | 602358 |
| RefSeq | NM_001524 |
| UniProt | O43612 |
| Otros datos | |
| Lugar geométrico | Chr. 17 q21 |
Orexin, también llamado hipocretina, es un neurotransmisor regula excitación, vigilia, y apetito.[1] La forma más común de narcolepsia, en que la víctima pierde brevemente del músculo del tono ()cataplejía), es causada por la falta de Orexina en el cerebro debido a la destrucción de las células que lo producen.[2]
El cerebro contiene muy pocas células que producen orexin; en un cerebro humano, unos 10.000 a 20.000 neuronas[2] En hipotálamo.[1] Sin embargo, la axones desde estas neuronas se extienden a lo largo de todo cerebro y la médula espinal,[3] donde también hay receptores para orexin.
Orexin fue descubierto en 1998 casi simultáneamente por dos grupos independientes de investigadores de cerebro de rata.[4][5] Un grupo llamado OrexinDe orexis, lo que significa "apetito" en griego; el otro grupo llamado hipocretina, porque se produce en el hipotálamo y débil se asemeja a secretina, una hormona encontrada en el intestino.[2] La comunidad científica todavía no resuelta en un consenso para que word utiliza.
Contenido
- 1 Isoformas
- 2 Función
- 2.1 Activación de grasa parda
- 2.2 Vigilia
- 2.3 Ingesta de alimentos
- 2.4 Potencial farmacológico
- 2.5 Metabolismo de los lípidos
- 2.6 Estado de ánimo
- 3 Historia y nomenclatura
- 4 Ligandos selectivos
- 5 Interacción con otros sistemas de neurotransmisores
- 6 Véase también
- 7 Referencias
- 8 Enlaces externos
Isoformas
Existen dos tipos de orexin: Orexin-A y -B (hipocretina-1 y -2). Son excitatorios neuropéptido hormonas con aproximadamente un 50% la identidad de secuencia, se producen por clivaje de la proteína precursora solo. Orexin es 33 residuos de aminoácidos de largo y tiene dos intracatenario disulfuro; Orexin-B es un péptido lineal de residuos del aminoácido 28. Los estudios sugieren que Orexina-A puede ser de mayor importancia biológica que orexin-B.[citación necesitada] Aunque estos péptidos son producidos por una población muy pequeña de células en el lateral y posterior hipotálamo, envían proyecciones a través del cerebro. Los péptidos de orexin se unen a los dos Proteína G acoplada Orexin receptores, OX1 y OX2, con Orexina-A atar a dos bueyes1 y buey2 con aproximadamente igual afinidad mientras orexin-B se une principalmente a OX2 y es 5 veces menos potente como buey1.[6]
Los orexins son péptidos fuertemente conservados, encontrados en todas las principales clases de vertebrados.[citación necesitada]
Función
El sistema de orexin inicialmente sugirió estar involucrados principalmente en la estimulación de la ingesta de alimentos, basado en el hallazgo de que la administración central de Orexina-A y la ingesta de alimentos creciente -B. Además, estimula la vigilia y energía gasto.
Activación de grasa parda
Obesidad en orexin ratones knockout es el resultado de la incapacidad de preadipocytes marrón para diferenciarse en tejido adiposo marrón (BAT), que alternadamente reduce BAT termogénesis. BATE la diferenciación puede ser restaurada en estos ratones knockout a través de inyecciones de orexin. Deficiencia en Orexina también ha sido relacionada con narcolepsia, un trastorno del sueño. Además la gente narcoléptico es más propensas a ser obesos. Por lo tanto, la obesidad en pacientes narcolépticos puede ser debido a la deficiencia de orexin a gasto deteriorado de la termogénesis y la energía.[7]
Vigilia
Orexin parece promover la vigilia. Estudios recientes indican que un papel importante del sistema de orexin es integrar circadiano, metabólicos y deuda de sueño influye para determinar si debe ser un animal dormido o despierto y activo. Las neuronas de Orexina fuertemente excitan varios núcleos cerebrales con papeles importantes en vigilia, incluyendo el dopamina, norepinefrina, histamina y acetilcolina sistemas[8][9] y parecen jugar un papel importante en la estabilización de vigilia y sueño.
El descubrimiento de que una mutación del receptor del orexin provoca la trastorno del sueño canino narcolepsia[10] en Doberman Pinschers posteriormente indica un papel importante para este sistema en sueño regulación. Ratones knockout genéticos carentes del gen para la Orexina también se informó que exhiben la narcolepsia.[11] Rápidamente y con frecuencia la transición entre el sueño y la vigilia, estos ratones muestran muchos de los síntomas de la narcolepsia. Los investigadores están usando este modelo animal de narcolepsia para estudiar la enfermedad.[12] Resultados de la narcolepsia en la somnolencia diurna excesiva, incapacidad para consolidar la vigilia en el día (y dormir por la noche), y cataplejía, que es la pérdida de tono muscular en respuesta a las emociones fuertes, generalmente positivas,. Los perros que carecen de un receptor funcional de orexin tienen narcolepsia, mientras que los animales y la gente carece el neuropéptido Orexina sí mismo también tiene narcolepsia.
Administración central de orexin A fuertemente promueve la vigilia, aumenta la temperatura corporal, locomoción y provoca un fuerte aumento del gasto de energía. Privación del sueño también aumenta la transmisión Orexina-A. El sistema de orexin así puede ser más importante en la regulación del gasto energético que la ingesta de alimentos. De hecho, pacientes narcolépticos orexin-deficientes han aumentado la obesidad más disminuido BMI, como podría esperarse si orexin fueron principalmente un apetito estimulando peptídica. Otra indicación de que los déficits de orexin causa narcolepsia es privar a los monos de dormir 30 – 36 horas y luego inyectarlas con los neuroquímicos alivia las deficiencias cognoscitivas que normalmente se ven con tal cantidad de pérdida de sueño.[13][14]
En los seres humanos, narcolepsia se asocia con una variante específica de la antígeno leucocitario humano Complejo (HLA).[15] Además, genoma análisis demuestra que, además de la variante HLA, seres humanos narcolépticos también exhiben una genética específica mutación En T-cell receptor locus alfa.[16] En conjunto, estas anomalías genéticas causan al sistema inmunitario a atacar y matar a las neuronas de Orexina crítico. Por lo tanto, la ausencia de producción de Orexina neuronas en los seres humanos narcolépticos puede ser el resultado de un autoinmune trastorno.[17]
Ingesta de alimentos
Orexin aumenta el ansia por la comida y se correlaciona con la función de las sustancias que promueven su producción.
Leptina es una hormona producida por las células de grasa y actúa como una medida interna a largo plazo de estado de energía. Ghrelina es un factor a corto plazo secretado por el estómago justo antes de una comida prevista y promueve fuertemente la ingesta de alimentos.
Las células productoras de orexin se han demostrado recientemente para ser inhibida por la leptina (a través de la vía del receptor de leptina), pero son activadas por la ghrelina y hipoglucemia (glucosa inhibe la producción de orexina). Orexin, a partir de 2007, se afirma que es un vínculo muy importante entre el metabolismo y la regulación del sueño.[citación necesitada] Esa relación ha sido sospechada durante mucho tiempo, basada en la observación que privación del sueño a largo plazo en roedores aumenta dramáticamente la comida ingesta y el metabolismo energético, es decir, catabolismo, con letales consecuencias a largo plazo. Entonces la privación del sueño conduce a una falta de energía. Para compensar esta falta de energía, muchas personas utilizan alimentos alta en carbohidratos y alta en grasas que en última instancia pueden conducir a problemas de salud y aumento de peso. Otros nutrientes, aminoácidos, también pueden activar las neuronas de Orexina, y puede suprimir la respuesta de glucosa de neuronas de Orexina en concentración fisiológica, causando el balance energético que orexin mantiene para ser lanzado apagado su ciclo normal.[18]
Potencial farmacológico
La investigación sobre los imitadores orexin está todavía en una fase temprana, aunque muchos científicos creen que podrían ayudar medicamentos basados en orexin narcoleptics y aumentar la vigilancia en el cerebro sin los efectos secundarios de anfetaminas.
Merck informó en el sueño la Conferencia 2012 insomnes tomando un bloqueador de orexin, suvorexant, se quedó dormido más rápido y dormir una hora más. Suvorexant fue probado durante tres meses en más de 1 mil pacientes en una fase III ensayo. Survorexant ha sufrido tres ensayos de fase III y estará disponible en finales del 2014 o principios del 2015 como "Belsomra".
Se ha realizado la investigación preliminar que muestra potencial para orexin bloqueadores en el tratamiento de alcoholismo. Ratas de laboratorio teniendo en cuenta las drogas que dirigido el sistema orexin perdida interés en alcohol a pesar de ser dado acceso gratuito en los experimentos.[19][20]
Un estudio ha reportado el trasplante de neuronas de Orexina en del pontine formación reticular en ratas es factibles, lo que indica el desarrollo de estrategias terapéuticas alternativas además de las intervenciones farmacológicas para tratar la narcolepsia.[21]
Porque los receptores Orexina-A se ha demostrado que regulan la recaída a la búsqueda de cocaína, un nuevo estudio investigó a su relación con la nicotina mediante el estudio de las ratas. Al bloquear el receptor Orexina-A con dosis bajas del antagonista selectivo SB-334.867, nicotina autoadministración disminuido y también la motivación para buscar y obtener la droga. El estudio mostró que el bloqueo de los receptores en el Insula disminuido autoadministración, pero no de bloqueo de los receptores en el adyacente Corteza somatosensorial. La mayor disminución de autoadministración se encontró al bloquear todos los receptores Orexina-A en el cerebro como un todo. Una justificación para este estudio fue el hecho de que la ínsula se ha implicado en la regulación de sentimientos de ansiedad. La ínsula contiene los receptores Orexina-A. Se ha reportado que los fumadores que sufrió daños a la ínsula perdieron el deseo de fumar.[22]
Metabolismo de los lípidos
Orexin-A (OXA) se ha demostrado recientemente que tienen efecto directo sobre una parte de la lípidos metabolismo. Estimula la OXA glucosa absorción en 3T3-L1 adipocitos y la absorción de ese aumento de la energía se almacena como los lípidos (triacilglicerol). Aumenta así la OXA lipogénesis. También inhibe lipolisis y estimula la secreción de adiponectina. Estos efectos se piensan para ser atribuidas principalmente mediante la PI3K camino porque este inhibidor de la vía (LY294002) bloquea completamente los efectos OXA en los adipocitos.[23] El vínculo entre OXA y el metabolismo de los lípidos es nueva y actualmente bajo investigación.
Obesidad en orexin-ratones knockout se asocia con deterioro tejido adiposo marrón termogénesis.[7]
Estado de ánimo
Altos niveles de Orexina-A se han asociado con la felicidad en sujetos humanos, mientras que niveles bajos se han asociado con tristeza.[24] El hallazgo sugiere que aumentar los niveles de orexin A podría elevar estado de ánimo en los seres humanos, siendo así un posible futuro tratamiento para trastornos como la depresión. Asimismo, ayuda a explicar la incidencia de depresión asociada con narcolepsia.
Historia y nomenclatura
En 1996, Gautvik, de Lecea y sus colegas informaron del descubrimiento de varios genes en el cerebro de la rata, incluyendo uno que apodado "clon 35." Su trabajo demostró que expresión 35 clon era limitada en el hipotálamo lateral.[25]
Masashi Yanagisawa y sus colegas en el Universidad de Texas Southwestern Medical Center en Dallas, acuñó el término Orexin para reflejar la actividad orexígeno (estimulante de apetito) de estas hormonas. En su papel de 1998 (con autoría atribuida a Sakurai y colegas) describiendo estos neuropéptidos, también reportaron descubrimiento de dos receptores de orexin, apodado buey1R y buey2R.[4]
En 1998, Luis de Lecea, Thomas Kilduff, y colegas también informaron el descubrimiento de estos péptidos mismos, les doblaje Hipocretinas para indicar que son sintetizados en el hipotálamo y para reflejar su semejanza estructural con la hormona secretina (es decir, hipotalámico secretino). Este es el mismo grupo que primero identificado clon 35 dos años antes.[5][25] De Lecea y sus colegas eran originalmente en busca de nuevos genes expresados en el hipotálamo. Para hacer esto, extrajeron ADN selectiva en el hipotálamo lateral. Se clonó este ADN y estudió bajo microscopia electrónica. Los neurotransmisores que se encuentran en esta zona eran extrañamente similares a la hormona intestinal, secretina, así de Lecea decidió nombrar las dos formas de péptidos hipocretina-1 y hypocretin-2.[26] Estas células primero fueron pensadas para residir y trabajar sólo dentro del área del hipotálamo lateral, pero las tácticas immunocytochemmistry revelaron las diversas proyecciones esta área tenía verdaderamente a otras partes del cerebro. La mayoría de estas proyecciones alcanzó el sistema límbico y las estructuras asociadas (incluyendo la amígdala, tabique y área del prosencéfalo basal).
El nombre de esta familia de péptidos es actualmente un problema sin resolver. El nombre "orexin" ha sido rechazado por algunos debido a la evidencia que los efectos orexígeno de estos péptidos pueden ser accidentales o trivial (es decir, orexin inducida por temas comen más porque son más despiertos), aunque esta cuestión es también sin resolver, mientras que otros grupos sostienen que el nombre "hipocretina" es incómodo, señalando que muchos neuropéptidos tienen nombres que no están relacionados con sus funciones más importantes, y que despertar es uno de los factores importantes que admite alimentación comportamiento. Tanto "orexin" y "hipocretina" probablemente seguirá apareciendo en obras publicadas hasta un nombre preferido ha sido aceptado por la comunidad científica.
Ligandos selectivos
Varios fármacos[27] actuando sobre el sistema de orexin están bajo desarrollo, tampoco orexin agonistas para el tratamiento de condiciones tales como narcolepsia, o antagonistas de orexin para insomnio. No No péptido agonistas todavía están disponibles, aunque polipéptido sintético de Orexina-A ha sido puesto a disposición como un aerosol nasal y probado en monos. Varios antagonistas del péptido no están en desarrollo SB-649.868 está en desarrollo por GlaxoSmithKline para trastornos de sueño y es un antagonista del receptor de orexin no selectivo. Otro buey1 y buey2 antagonista de los receptores (ACT-078573, almorexant) es un compuesto similar en desarrollo para el insomnio primario por Actelion. Una tercera entrada es Merck MK-4305.[28]
La mayoría ligandos actúan sobre el sistema de orexin hasta ahora son polipéptidos modificados a partir de los agonistas endógenos Orexina-A y Orexin-B, sin embargo hay algunos antagonistas del péptido no selectivo de subtipo disponibles para fines de investigación.
- SB-334.867 – BUEY selectivo1 antagonista
- SB-408.124 – BUEY selectivo1 antagonista
- TCS-OX2-29 – BUEY selectivo2 antagonista
- EMPA(Drug) (N-Ethyl-2-[(6-methoxy-pyridin-3-yl)-(toluene-2-sulfonyl)-amino]-N-pyridin-3-ylmethyl-acetamide) – buey selectivo2 antagonista
Interacción con otros sistemas de neurotransmisores
|
|
En esta sección también puede ser técnica para la mayoría de los lectores a entender. (Octubre de 2013) |
Las neuronas Orexinergic han demostrado ser sensibles a las entradas de grupo III receptores metabotrópicos del glutamato,[29] adenosina A1 receptores,[30] muscarínico M3 receptores,[31] serotonina 5-HT1A receptores,[32] neuropéptido Y receptores,[33] receptores A la colecistoquinina,[34] y catecolaminas,[35][36] así como a ghrelina, leptina, y glucosa.[37] Orexinergic las neuronas regulan la liberación de acetilcolina,[38][39] serotonina y noradrenalina,[40] Así que a pesar del relativamente pequeño número de neuronas orexinergic en comparación con otros sistemas de neurotransmisores en el cerebro, este sistema desempeña un papel regulador clave y se requerirá una investigación exhaustiva para desentrañar los detalles. Orexins ley de Proteína GQ-señalización a través de los receptores acoplados Fosfolipasa C (PLC) y dependiente de calcio así como vías de transducción de calcio-independiente. Estos incluyen la activación de electrógenos Intercambiadores de sodio-calcio (NCX) y una conductancia catiónica inespecíficos, canales probables de la potencial del receptor transitoria canónicaActivación de tipo-(TRPC) de Canales de calcio dependientes de voltaje tipo L, cierre de Canales de potasio rectificador interno G proteína-activado (GIRK) y la activación de proteínas quinasas, incluyendo proteína quinasa C (PKC), kinase de proteína A (PKA) y asociada a mitógenos proteína quinasa, también llamado proteína quinasa activada por mitógeno (MAPK). Postsinápticas acciones de orexins en sus numerosos objetivos neuronales en el SNC son casi en su totalidad excitatorias.[41]
Véase también
- Leptina
Referencias
- ^ a b Davis JF, DL Choi, Benoit SC (2011). "24. orexígeno péptidos hipotalámicos comportamiento y alimentación - 24.5 Orexin". Preedy VR, Watson RR, Martin CR. Manual de comportamiento, alimentación y nutrición. Springer. págs. 361 – 2. ISBN9780387922713.
- ^ a b c Centro de Stanford para la narcolepsia Preguntas más frecuentes (consultado el 27 de marzo de 2012)
- ^ Marcus JN, Elmquist JK (2006). "3. Orexin proyecciones y localización de los receptores de Orexin". Nishino s, Sakurai T. El sistema de Orexina/hipocretina: Fisiología y Fisiopatología. Springer. p. 195. ISBN9781592599509.
- ^ a b Amemiya A, Sakurai T, Matsuzaki, Ishii M I, Chemelli RM, Tanaka H, Williams SC, Richardson JA, GP Kozlowski, Wilson S, Arch JR, Buckingham RE, Haynes AC, Carr SA, Annan RS, DE McNulty, Liu WS, Terrett JA, Elshourbagy NA, Bergsma DJ, Yanagisawa M (1998). "Los receptores Orexins y orexin: una familia de neuropéptidos hipotalámicos y receptores acoplados a proteína G que regulan el comportamiento de alimentación". Celular 92 (4): 573-85. Doi:10.1016/S0092-8674 (00) 80949 USA-6. PMID9491897.
- ^ a b de Lecea L, TS Kilduff, Peyron C, Gao X, Foye PE, PE Danielson, Fukuhara C, EL Battenberg, VT Gautvik, Bartlett FS, Frankel WN, van den Pol AN, Bloom FE, KM Gautvik, Sutcliffe JG (1998). "El hypocretins: péptidos específicos hipotálamo con actividad neuroexcitante". Proc. nacional Acad. Sci U.S.A. 95 (1): 322 – 7. Doi:10.1073/pnas.95.1.322. PMC18213. PMID9419374.
- ^ Langmead CJ, Jerman JC, Brough SJ, Scott C, Porter RA, Herdon HJ (enero de 2004). "Caracterización de la encuadernación de 3H-SB-674042, un antagonista de la novela nonpeptide, al receptor del orexin-1 humano". Br. J. Pharmacol. 141 (2): 340 – 6. Doi:10.1038/sj.BJP.0705610. PMC1574197. PMID14691055.
- ^ a b Sellayah D, Bharaj P, Sikder D (octubre de 2011). "Orexin es necesaria para la función, diferenciación y desarrollo del tejido adiposo marrón". La célula Metab. 14 (4): 478 – 90. Doi:10.1016/j.cmet.2011.08.010. PMID21982708. Extracto de laico – ScienceDaily.
- ^ Sherin JE JK Elmquist, Torrealba F, Saper CB (junio de 1998). "Inervación de las neuronas tuberomammillary histaminérgico por neuronas GABAérgicas y galaninergic en el núcleo preóptica ventrolateral de la rata". El diario de neurociencia 18 (12): 4705 – 21. PMID9614245.
- ^ Lu J, Bjorkum AA, Xu M, Gaus SE, Shiromani PJ, Saper CB (junio de 2002). "La activación selectiva del núcleo preóptica ventrolateral extendido durante el sueño de movimientos oculares rápidos". J Neurosci. 22 (11): 4568 – 76. PMID12040064.
- ^ Lin L, Faraco J, et al (1999). "La narcolepsia canina sueño trastorno es causada por una mutación en el gene del receptor 2 de hipocretina (orexina)". Celular 98 (3): 365-376. Doi:10.1016/S0092-8674 (00) 81965-0. PMID10458611.
- ^ Chemelli RM, Willie JT, et al (1999). "Narcolepsia en ratones knockout orexin: genética molecular de la regulación del sueño". Celular 98 (4): 437-451. Doi:10.1016/S0092-8674 (00) 81973-X. PMID10481909.
- ^ T Mochizuki, Crocker A, McCormack S, Yanagisawa M, Sakurai T, Scammell TE (julio de 2004). "Inestabilidad del comportamiento estatal en ratones knock-out orexin". J Neurosci. 24 (28): 6291 – 300. Doi:10.1523/JNEUROSCI.0586-04.2004. PMID15254084.
- ^ Alexis Madrigal (2007-12-28). "Inhalar una sustancia química del cerebro podría reemplazar a dormir". Noticias por cable, Condé Nast. de 2008-02-05.
- ^ Deadwyler SA, L Porrino, Siegel JM, Hampson RE (2007). "Entrega sistémica y nasal de hipocretina-Orexina-A (1) reduce los efectos de la privación del sueño sobre el rendimiento cognitivo en primates no humanos". J Neurosci. 27 (52): 14239 – 47. Doi:10.1523/JNEUROSCI.3878-07.2007. PMID18160631.
- ^ Klein J, Sato (septiembre de 2000). "El sistema de HLA. Segunda de dos partes". N. Engl. J. Med. 343 (11): 782 – 6. Doi:10.1056/NEJM200009143431106. PMID10984567.
- ^ Hallmayer J, J Faraco, Lin L, et al. (Junio de 2009). "Narcolepsia está fuertemente asociada con el locus alfa TCR". NAT Genet. 41 (6): 708 – 11. Doi:10.1038/ng.372. PMC2803042. PMID19412176.
- ^ "La narcolepsia es un desorden autoinmune, investigador de Stanford dice". EurekAlert. American Association for the Advancement of Science. 2009-05-03. 2009-05-31.
- ^ https://Journal.frontiersin.org/Journal/10.3389/FENDO.2013.00018/full
- ^ Helen Puttick (2006-12-26). "La esperanza en la lucha contra el alcoholismo". El Herald.
- ^ Lawrence AJ, Cowen MS, Yang HJ, Chen F, Oldfield B (2006). "El sistema de orexin regula la búsqueda de alcohol en ratas". Br. J. Pharmacol. 148 (6): 752 – 9. Doi:10.1038/sj.BJP.0706789. PMC1617074. PMID16751790.
- ^ Arias-Carrión O, Murillo-Rodriguez E, Xu M, Blanco-Centurion C, Drucker-Colín R, Shiromani PJ (2004). "El trasplante de neuronas Hypocretin en la formación Reticular Pontina: resultados preliminares". Dormir 27 (8): 1465 – 70. PMC1201562. PMID15683135.
- ^ "Bloqueando un Neuropeptide Receptor disminuye la adicción a la nicotina". ScienceDaily LLC. 2008-12-01. 2009-02-11.
- ^ Skrzypski M, Le TT, Kaczmarek P, Pruszynska-Oszmalek E, Pietrzak P, Szczepankiewicz D, Kolodziejski PA, Sassek M, A Arafat, Wiedenmann B, Nowak KW, Strowski MZ (julio de 2011). "Orexin A estimula la absorción de glucosa, secreción de acumulación y adiponectina lípidos de adipocitos 3T3-L1 y adipocitos aislados de rata primario". Diabetologia 5 (47): 1841 – 52. Doi:10.1007/s00125-011-2152-2. PMID21505958.
- ^ Blouin AM, frito yo, Wilson CL, Staba RJ, EJ Behnke, Lam, NT Maidment, Karlsson KÆ, Lapierre JL, Siegel JM (2013). "Humano hipocretina y melanina-concentrando los niveles hormonales están relacionados con emoción y la interacción social". Nature Communications 4:: 1547. Doi:10.1038/ncomms2461. PMC3595130. PMID23462990. Extracto de laico – Ciencia diariamente.
- ^ a b Gautvik KM, de Lecea L, et al (1996). "Panorama de los mRNAs específicos de hipotálamo más prevalentes, identificado por la etiqueta direccional resta PCR". PNAS 93 (16): 8733 – 8738. Doi:10.1073/pnas.93.16.8733. PMC38742. PMID8710940.
- ^ https://www.ncbi.nlm.nih.gov/PMC/articles/PMC1279673/
- ^ Heifetz A, Morris GB, Biggin PC, Barker O, Fryatt T, Bentley J, D Hallett, Manikowski DP, Pal S, Reifegerste R, M flojo, ley R (2012). "Estudio de Orexin humana-1 y-2 G-proteína-junto a los receptores con novela y publicado antagonistas de modelado, simulaciones de Dinámica Molecular y mutagénesis sitio-dirigida". Bioquímica 51 (15): 3178 – 3197. Doi:10.1021/bi300136h.
- ^ Baxter CA Cleator ED, Karel MJ, Edwards JS, Escariador RA, Sheen FJ, Stewart GW, Strotman NA, Wallace DJ (2011). "La primera síntesis a gran escala del MK-4305: un antagonista de los receptores de Orexin Dual para el tratamiento del trastorno del sueño". Desarrollo e investigación de proceso orgánico 15 (2): 367-375. Doi:10.1021/op1002853.
- ^ Acuña-Goycolea C, Li Y, Van Den Pol un (marzo de 2004). "Grupo III los receptores del glutamato metabotrópicos Mantén la inhibición tónica de entrada sináptica excitatoria hipocretina/orexin neuronas". J Neurosci. 24 (12): 3013 – 22. Doi:10.1523/JNEUROSCI.5416-03.2004. PMID15044540.
- ^ Liu ZW, Gao XB (enero de 2007). "Adenosina inhibe la actividad de las neuronas de hipocretina/orexin vía receptor A1 en el hipotálamo lateral: un posible efecto dormir-promover". J Neurophysiol. 97 (1): 837 – 48. Doi:10.1152/Jn.00873.2006. PMC1783688. PMID17093123.
- ^ Ohno K, M de Hondo, Sakurai T (marzo de 2008). "Regulación colinérgica de neuronas de Orexina/hipocretina mediante el receptor muscarínico M(3) en ratones". J. Pharmacol. SCI. 106 (3): 485 – 91. Doi:10.1254/jphs.FP0071986. PMID18344611.[link muerto]
- ^ Muraki Y Yamanaka A, Laudert N, Kilduff TS, Goto K, Sakurai T (agosto de 2004). "Regulación serotoninérgico de las neuronas de Orexina/hipocretina a través de los receptores 5-HT1A". J Neurosci. 24 (32): 7159 – 66. Doi:10.1523/JNEUROSCI.1027-04.2004. PMID15306649.
- ^ Fu LY, Acuña-Goycolea C, van den Pol un (octubre de 2004). "Neuropéptido Y inhibe las neuronas hipocretina/orexin por múltiples mecanismos presinápticos y postsinápticos: depresión tónico del sistema hipotalámico excitación". J Neurosci. 24 (40): 8741 – 51. Doi:10.1523/JNEUROSCI.2268-04.2004. PMID15470140.
- ^ Laudert N Yamanaka A K Ichiki, Muraki Y, Kilduff TS, Yagami K, Takahashi S, Goto K, Sakurai T (agosto de 2005). "La colecistoquinina activa las neuronas de Orexina/hipocretina a través de la colecistoquinina un receptor". J Neurosci. 25 (32): 7459 – 69. Doi:10.1523/JNEUROSCI.1193-05.2005. PMID16093397.
- ^ Y Li, van den Pol un (enero de 2005). "Directa e indirecta inhibición por catecolaminas de hipocretina/orexin neuronas". J Neurosci. 25 (1): 173-83. Doi:10.1523/JNEUROSCI.4015-04.2005. PMID15634779.
- ^ Yamanaka A Muraki Y K Ichiki, Laudert N, Kilduff TS, Goto K, Sakurai T (julio de 2006). "Las neuronas de Orexina son directa e indirectamente reguladas por las catecolaminas de manera compleja". J Neurophysiol. 96 (1): 284 – 98. Doi:10.1152/Jn.01361.2005. PMID16611835.
- ^ Ohno K, Sakurai T (enero de 2008). "Circuitos neuronales Orexin: papel en la regulación del sueño y la vigilia". Neuroendocrinol delantero 29 (1): 70 – 87. Doi:10.1016/j.yfrne.2007.08.001. PMID17910982.
- ^ Bernard R, Lydic R, Baghdoyan hectáreas (octubre de 2003). Hipocretina-1 provoca la activación de la proteína G y aumenta la liberación de ACh en pons de rata. EUR j Neurosci. 18 (7): 1775 – 85. Doi:10.1046/j.1460-9568.2003.02905.x. PMID14622212.
- ^ Frederick-Duus D, Guyton MF, Fadel J (noviembre de 2007). "Sacados de alimentos aumenta en la liberación de acetilcolina cortical requiere orexin transmisión". Neurociencia 149 (3): 499-507. Doi:10.1016/j.Neuroscience.2007.07.061. PMID17928158.
- ^ SoFFin EM, Gill CH, Brough SJ, Jerman JC, Davies CH (junio de 2004). "Caracterización farmacológica del subtipo del receptor orexin mediar postsináptica excitación en el núcleo dorsal del Rafe rata". Neurofarmacología 46 (8): 1168 – 76. Doi:10.1016/j.neuropharm.2004.02.014. PMID15111023.
- ^ Selbach O, Haas HL (2006). "Hypocretins: los tiempos de sueño y vigilia". Cronobiología internacional 23 (1 – 2): 63-70. Doi:10.1080/07420520500545961. PMID16687280.
Enlaces externos
- orexins en las E.E.U.U. Biblioteca Nacional de medicina Encabezamientos de materia médica (Malla)
- https://www.sleepfoundation.org/article/Compare-different-Sleep-AIDS
- https://www.sleepfoundation.org/Alert/Drug-May-offer-New-Approach-treating-Insomnia
- https://www.sleepfoundation.org/article/Orexin-receptor-antagonists-New-Class-Sleeping-Pill
|
||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||
Otras Páginas
- Servicio de los inversores (categoria empresas fundadas en 1909) de Moody
- Principios de Thimpu
- Karl Malone (categoria deportistas de Newport Beach, California)
- Marquette National Bank of Minneapolis v. Primero de Omaha Service Corp.
- Los Mongols Motorcycle Club
- Balch y Bingham
- Regla de Kollner
- La persona altamente sensible (libro)
- Asociado-O-Matic