Precipitación del etanol
Etanol precipitación se utiliza un método para purificar y concentrar RNA, DNA y polisacáridos tales como pectina y Xyloglucan De soluciones acuosas mediante la adición de etanol como un antisolvent.
Contenido
- 1 Precipitación del ADN
- 1.1 Teoría de la
- 1.2 Práctica
- 1.2.1 Protocolo
- 2 Véase también
- 3 Referencias
- 4 Enlaces externos
Precipitación del ADN
Teoría de la

El ADN es polar debido a su altamente cargada fosfato de columna vertebral. Su polaridad es soluble en agua (el agua es polar) según el principio de "como disuelve como".
Debido a la alta polaridad del agua, ilustrado por su alto constante dieléctrica de 80.1 (a 20 ° C), electrostático fuerzas entre partículas cargadas son considerablemente más bajas en la solución acuosa que están en un vacío o en el aire.
Esta relación se refleja en Ley de Coulomb, que puede utilizarse para calcular la fuerza que actúa sobre dos cargos  y
y 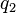 separadas por una distancia
separadas por una distancia  mediante el uso de la constante dieléctrica
mediante el uso de la constante dieléctrica 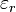 (también llamado constante dieléctrica estática relativa) del medio en el denominador de la ecuación ()
(también llamado constante dieléctrica estática relativa) del medio en el denominador de la ecuación ()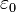 es un constante eléctrica):
es un constante eléctrica):

En un nivel atómico, resultados de la reducción en la actuación de la fuerza sobre una carga de las moléculas de agua formando un cáscara de hidratación alrededor de él. Este hecho hace muy buen solvente para compuestos cargados como las sales del agua. Fuerza eléctrica que normalmente contiene sal cristales juntos a modo de bonos de Ionic se debilita en presencia de agua, permitiendo que los iones a separar el cristal y difundir a través de la solución.
El mismo mecanismo opera en el caso de los grupos fosfato cargados negativamente sobre una espina dorsal de la DNA: a pesar de que los iones positivos están presentes en la solución, la fuerza electrostática neta relativamente débil les impide formando lazos de iónico estables con fosfatos y precipitación de la solución.
Etanol es mucho menos polar que el agua, con una constante dieléctrica de 24.3 (a 25 ° C). Esto significa que agregar etanol a solución interrumpe la proyección de cargas por agua. Si se agrega suficiente etanol, la atracción eléctrica entre los grupos fosfato y cualquier iones positivos presentes en solución se convierte en lo suficientemente fuerte para formar estable bonos de Ionic y la precipitación de ADN. Esto sucede generalmente cuando etanol compone más 64% de la solución. Como sugiere el mecanismo, la solución tiene que contener los iones positivos de precipitación que ocurra; generalmente Na+, NH4+ o Li+ desempeña este papel.[1]
Práctica

ADN es precipitado por el primero asegurando que existe la correcta concentración de los iones positivos en solución (demasiado resultará en una gran cantidad de sal Co precipitar con el ADN, muy poco dará lugar a la recuperación incompleta del ADN) y luego agregando dos o tres volúmenes de al menos el 95% etanol. Muchos protocolos aconsejan almacenar ADN a baja temperatura en este punto, pero también hay una observación que no mejora la recuperación de ADN y pueden incluso menor eficiencia de precipitación durante el uso de tiempo de la incubación de noche.[2][3] En la mayoría de los casos se logra buena eficacia a temperatura ambiente pero cuando posible degradación se tiene en cuenta que es probablemente mejor incubar el ADN en hielo húmedo. Tiempo de incubación óptimo depende de la longitud y la concentración de ADN. Fragmentos más pequeños y concentraciones más bajas se requieren tiempos más largos para lograr recuperación aceptable. Para longitudes muy pequeñas y bajas concentraciones se recomienda la incubación de noche. En tales casos el uso de portadores como tRNA, glicógeno o lineal poliacrilamida puede mejorar enormemente la recuperación.
Durante la incubación el ADN y algunas sales precipita de la solución, en el siguiente paso de por que este precipitado se recoge centrifugación en un tubo de microcentrífuga a altas velocidades (~ 12.000g). Tiempo y la velocidad de la centrifugación tiene el mayor efecto sobre las tasas de recuperación de ADN. Otra vez fragmentos más pequeños y las diluciones más altas requieren centrifugación más largo y más rápido. Centrifugación puede realizarse a temperatura ambiente o en 4 ° C o 0 ° C. Durante la centrifugación ADN precipitado tiene que moverse a través de solución de etanol en la parte inferior del tubo, aumentan la temperaturas más bajas viscosidad de la solución y mayores volúmenes hacer la distancia más larga, así que tanto los factores baja eficiencia de este proceso requiere centrifugación más larga para el mismo efecto.[2][3] Después de la centrifugación la solución sobrenadante se retira dejando una pellets de de ADN crudo. Si el sedimento es visible depende de la cantidad de ADN y en su pureza (más sucios pellets son fáciles de ver) o el uso de co precipitados.
En el siguiente paso, etanol al 70% se agrega a los pellets, y se mezcla suavemente para romper los pellets sueltos y lavarlo. Esto quita algunas de las sales presentes en el sobrenadante restante y obligadas a pellet de ADN haciendo que el ADN final limpiador. Esta suspensión se centrifuga nuevamente para una vez más de la pelotilla de ADN y se elimina la solución sobrenadante. Este paso se repite una vez.
Finalmente, el sedimento se secan al aire y el ADN se resuspendió en agua u otros deseado tampón de. Es importante no secar demasiado la pelotilla como puede llevar a desnaturalización de ADN y hacer más difícil volver a suspender.
Isopropanol también se puede utilizar en lugar de etanol; la eficiencia de la precipitación del isopropanol es mayor que un volumen suficiente para la precipitación. Sin embargo, el isopropanol es menos volátil que el etanol y necesita más tiempo para secar al aire en la etapa final. El balín podría también se adhieren menos firmemente al tubo al utilizar isopropanol.[1]
Protocolo
- Añadir el 1/10 volumen de acetato de sodio (3 M, pH 5.2).
- Agregue 2.5 – 3.0 volumen X (calculada después de adición de acetato de sodio) de al menos 95% etanol.
- Incubar en hielo por 15 minutos. En el caso de pequeños fragmentos de ADN o altas diluciones noche incubación da mejores resultados, incubación por debajo de 0 ° C no mejorar significativamente la eficiencia.[2][3]
- Centrifugar a 14.000 > x g durante 30 minutos a temperatura ambiente o 4 ° C.
- Deseche el sobrenadante teniendo cuidado de no tirar pellet de DNA que puede o no ser visible.
- Enjuagar con etanol al 70%
- Centrifugar nuevamente por 15 minutos.
- Deseche el sobrenadante y disolver el pellet en buffer deseado. Asegúrese de que el búfer entra en contacto con toda la superficie del tubo ya que una porción significativa de la DNA puede depositarse en las paredes en vez de en el sedimento.[1]
Véase también
- Extracción de ADN
- Salazón en
- Salazón
Referencias
- ^ a b c Clonación molecular: Un Manual de laboratorio (tercera edición) por José Sambrook, Peter MacCallum Cancer Institute, Melbourne, Australia; David Russell, University of Texas Southwestern Medical Center, Dallas
- ^ a b c Zeugin JA, Hartley JL (1985). "Etanol precipitación del ADN" (PDF). Enfoque 7 (4): 1 – 2. 2008-09-10.
- ^ a b c Crouse J, Amorese D (1987). "Precipitación de etanol: acetato de amonio como alternativa al acetato de sodio" (PDF). Enfoque 9 (2): 3 – 5. 2008-09-10.
Enlaces externos
- bitesizebio.com los conceptos básicos: Cómo etanol precipitación de DNA y RNA obras
- Zeugin JA, Hartley JL (1985). "Etanol precipitación del ADN" (PDF). Enfoque 7 (4): 1 – 2. 2008-09-10.
- Crouse J, Amorese D (1987). "Precipitación de etanol: acetato de amonio como alternativa al acetato de sodio" (PDF). Enfoque 9 (2): 3 – 5. 2008-09-10.
Otras Páginas
- Timeline del telefono
- Astrologia medica
- Teoria de Japhetic
- Medicina Siddha
- Ted Stevens (Universidad de California, Los Angeles antiguos alumnos de la categoria)
- Proveedor de servicios en linea
- Edward y Elaine Brown
- Sublimacion (transicion de fase)
- Linfoma
- Perjuicio irreparable
- Software de amiga
- El proceso de relampago
- Zhang Weihong
- Disfigurehead
- Vivo en CBGB 1982