Proporción de aire – combustible
|
|
Este artículo Necesita referencias adicionales para verificación. (Octubre de 2008) |
Proporción de aire – combustible (AFR) es la relación entre la masa de aire Para combustible presentes en un combustión procesos tales como en un motor de combustión interna u horno industrial. Si exactamente suficiente aire se suministra totalmente quemar todo el combustible, la relación es conocida como la estequiométricas mezcla, abreviado a menudo a estoico. Para los cálculos exactos de AFR, la oxígeno contenido de aire de combustión debe especificarse por dilución posible por ambiente vapor de agua, o enriquecimiento por las adiciones de oxígeno. El AFR es una medida importante por razones contra la contaminación y tuning de la performance. Cuanto menor el AFR, la mezcla de los "más rica".
Contenido
- 1 Sinopsis
- 2 Sistemas de gestión de motor
- 3 Otros tipos de motor
- 4 Otros términos usados
- 4.1 Mezcla
- 4.2 Proporción de aire – combustible (AFR)
- 4.3 Proporción de aire – combustible (ahora)
- 4.4 Relación de equivalencia de aire – combustible (λ)
- 4.5 Relación de equivalencia de combustible – aire (ϕ)
- 4.6 Fracción de mezcla
- 4.7 Aire de combustión exceso por ciento
- 5 Véase también
- 6 Referencias
- 7 Enlaces externos
Sinopsis
En teoría una mezcla estequiométrica tiene suficiente aire para quemar totalmente el combustible disponible. En la práctica nunca para lograrlo, debido principalmente al muy poco tiempo disponible en un motor de combustión interna para cada ciclo de combustión. La mayor parte del proceso de combustión completa en aproximadamente 4 a 5 milisegundos a una velocidad de motor de 6.000rpm. (100 revoluciones por segundo; 10 milisegundos por revolución) Este es el tiempo que transcurre desde cuando la chispa se dispara hasta la quema de la mezcla aire – combustible es prácticamente completa después de unos 80 grados de rotación del cigüeñal. Convertidores catalíticos están diseñados para funcionar mejor cuando los gases de escape pasan a través de ellos son el resultado de la combustión casi perfecta.
Una mezcla estequiométrica desafortunadamente quema muy caliente y puede dañar los componentes del motor si el motor está colocado bajo alta carga en esta mezcla aire – combustible. Debido a las altas temperaturas en esta mezcla, mezcla de detonación del combustible – aire poco después de que la presión máxima del cilindro es posible bajo alta carga (conocida como golpeando o golpeteo). Detonación puede causar daños graves en el motor como la quema incontrolada de la mezcla de aire combustible puede crear presiones muy altas en el cilindro. Como consecuencia, sólo se utilizan mezclas estequiométricas bajo condiciones de carga ligera. Para las condiciones de alta carga y aceleración, se utiliza una mezcla más rica (proporción de aire – combustible inferior) para producir más productos de la combustión y evitando la detonación y el sobrecalentamiento de la culata.
Sistemas de gestión de motor
El estequiométricas mezcla para un motor de gasolina es la proporción ideal de aire al combustible que quema todo el combustible con ningún exceso de aire. Para gasolina combustible, la mezcla estequiométrica aire – combustible es de 15:1[1] es decir, para cada un gramo de combustible, 15 gramos de aire son necesarios. La reacción de oxidación del combustible es:

Cualquier mezcla superior a ~ 15 a 1 se considera un mezcla pobre; menos de ~ 15 a 1 es un Mezcla rica – dado perfecta "prueba" (ideal) combustible (gasolina consiste únicamente n -heptano y ISO-octano). En realidad, la mayoría de los combustibles consisten en una combinación de heptano, octano, un puñado de otros alcanos, además de aditivos incluyendo detergentes y posiblemente oxigenadores como MTBE (éter metil tert-butílico) o etanol/metanol. Todos estos compuestos alteran la relación estequiométrica, con la mayoría de los aditivos empujando hacia abajo el cociente (oxigenadores traen oxígeno extra para el evento de combustión en forma líquida que se libera en el momento de combustiones; para MTBE-carga de combustible, una relación estequiométrica puede ser tan baja como 14.1:1). Los vehículos que usan un sensor de oxígeno u otro circuito de retroalimentación para el control de combustible a aire ratio (control lambda), compensar automáticamente este cambio en la tasa estequiométricas de combustible midiendo la composición del gas de escape y controlar el volumen de combustible. Vehículos sin tales controles (tales como motocicletas más hasta hace poco y los coches anteriores a mediados de la década de 1980) pueden tener dificultades funcionando ciertas combustible mezcla (especialmente invierno los combustibles utilizados en algunas áreas) y puede requerir diferentes chorros (o si no han alterado las proporciones de combustible) para compensar. Vehículos que usan sensores de oxígeno puede controlar la proporción de aire – combustible con un medidor de aire – combustible cociente.
Otros tipos de motor
En el aire típico para quemador de combustión de gas natural, una estrategia de doble Cruz límite se emplea para asegurar control de ratio. (Este método fue utilizado en la II Guerra Mundial).[citación necesitada] La estrategia implica agregar la retroalimentación flujo opuesto en el control limitador de los respectivos gases (aire o combustible). Esto asegura control de relación dentro de un margen aceptable.
Otros términos usados
Hay otros términos usados comúnmente cuando se habla de la mezcla de aire y combustible en motores de combustión interna.
Mezcla
Mezcla es la palabra predominante que aparece en textos de capacitación, manuales de operación y manuales de mantenimiento en el mundo de la aviación.
Proporción de aire – combustible (AFR)
El proporción de aire – combustible se utiliza el término más común de referencia para las mezclas en motores de combustión interna. El término también se utiliza para definir mezclas utilizadas para industrial horno calentado por combustión. El AFR en unidades de masa se emplea en Fuel-oil despedida de hornos, mientras que volumen (o Mole) unidades se utilizan para gas natural Hornos de leña.

Proporción de aire – combustible es la relación entre el masa del aire y la masa de combustible en la mezcla de aire combustible – en cualquier momento dado. La masa es la masa de todos los componentes que componen el combustible y el aire, ya sea combustible o no. Por ejemplo, un cálculo de la masa de gas natural — que a menudo contiene dióxido de carbono (CO
2), nitrógeno (N
2) y varios alcanos— incluye la masa de dióxido de carbono, nitrógeno y alcanos todos para determinar el valor de  .[2]
.[2]
Por pura octano la mezcla estequiométrica es aproximadamente 14.7: 1, o λ de 1.00 exactamente.
En motores naturalmente aspirados accionados por octano, potencia máxima se alcanza con frecuencia a AFRs desde 12.5 hasta 13.3:1 o λ de 0.850 a 0,901.
Proporción de aire – combustible (ahora)
Relación combustible – aire se utiliza comúnmente en la turbina de gas industria así como en estudios de gobierno de motor de combustión internay se refiere a la proporción de combustible en el aire.[citación necesitada]

Relación de equivalencia de aire – combustible (λ)
Relación de equivalencia de aire – combustible, λ (lambda), es el cociente de AFR real a estequiometría para una determinada mezcla. Λ = 1.0 está en estequiometría, ricas mezclas λ < 1.0 y mezclas magra λ > 1.0.
Hay una relación directa entre λ y AFR Para calcular AFR de un determinada λ, multiplique el λ medido por el AFR estequiométrico para ese combustible. Alternativamente, para recuperarse λ de un AFR, dividir AFR por el AFR estequiométrico para ese combustible. Esta última ecuación se utiliza a menudo como la definición de λ:
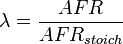
Por la composición de los combustibles comunes varía estacionalmente, y porque muchos vehículos modernos pueden manejar diferentes combustibles, al afinar, tiene más sentido hablar de valores λ en lugar de AFR
Dispositivos más prácticos de AFR medir la cantidad de oxígeno residual (para las mezclas de magras) o Hidrocarburos incombustos (para mezclas ricas) en los gases de escape como en PPCHS.
Relación de equivalencia de combustible – aire (ϕ)
El relación de equivalencia de combustible – aire, Φ (phi), de un sistema se define como el cociente de la relación combustible-a-oxidante a la relación estequiométrica de combustible-para-oxidante. Matemáticamente,

donde, m representa la masa, n representa el número de moles, sufijo st soportes para condiciones estequiométricas.
La ventaja de usar la relación de equivalencia sobre relación combustible-oxidante es eso toma en cuenta (y por lo tanto es independiente de) los valores tanto en masivos como molares para el combustible y el oxidante. Consideremos, por ejemplo, una mezcla de un mol de etano (C
2H
6) y un mol de oxígeno (O
2). La proporción de combustible – oxidante de esta mezcla basada en la masa de combustible y aire es

y la relación combustible-oxidante de esta mezcla basándose en el número de moles de combustible y aire

Claramente los dos valores no son iguales. Para compararla con la relación de equivalencia, debemos determinar la relación combustible-oxidante de mezcla de etano y oxígeno. Para ello es necesario considerar la reacción estequiométrica de etano y oxígeno,

Esto le da

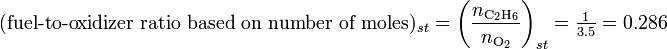
Así podemos determinar la relación de equivalencia de la mezcla dada como

o, en su equivalente,
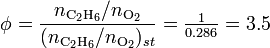
Otra ventaja de usar la relación de equivalencia es que las proporciones mayores que uno siempre hay más combustible en la mezcla de combustible – oxidante de lo necesario para una combustión completa (reacción estequiométrica), cualquiera que sea el combustible y el oxidante se utiliza, mientras que las proporciones menos uno representa una deficiencia de combustible o equivalente exceso oxidante en la mezcla. Esto no es el caso si una proporción de combustible – oxidante usos, que toma diferentes valores para diferentes mezclas.
La relación de equivalencia de aire – combustible se relaciona con el aire – combustible equivalencia cociente (previamente definido) como sigue:

Fracción de mezcla
Las cantidades relativas de dilución de combustible y enriquecimiento de oxígeno pueden ser cuantificadas por la fracción de mezcla, Z, definida como ![Z = \left[ \frac{s Y_F - Y_O + Y_{O,0}}{s Y_{F,0} + Y_{O,0}} \right]](http://upload.wikimedia.org/math/6/5/e/65e1703f0ebc31385fd0f4223709c98e.png) , donde
, donde  ,
,  y
y 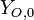 representan las fracciones masas de combustible y oxidante en la entrada,
representan las fracciones masas de combustible y oxidante en la entrada, 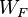 y
y 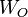 son los pesos moleculares de las especies, y
son los pesos moleculares de las especies, y  y
y  son el combustible y oxígeno coeficientes estequiométricos, respectivamente. La fracción de la mezcla estequiométrica es
son el combustible y oxígeno coeficientes estequiométricos, respectivamente. La fracción de la mezcla estequiométrica es ![Z_{st} = \left[ \frac{1}{1 + \frac{Y_{F,0} \cdot W_O \cdot v_O}{Y_{O,0} \cdot W_F \cdot v_F}} \right ]](http://upload.wikimedia.org/math/0/3/8/038f14855f958499a9d6dd97b885247d.png) [3] Se relaciona con la fracción de mezcla stoichiomteric
[3] Se relaciona con la fracción de mezcla stoichiomteric 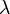 (lambda) y
(lambda) y  (phi) mediante las ecuaciones
(phi) mediante las ecuaciones  , asumiendo
, asumiendo  [4]
[4]
Aire de combustión exceso por ciento

En industrial Hornos, planta de energía generadores eléctricos de vapor y grandes turbinas de combustión de gas, los términos más comunes son por ciento estequiométrica aire y aire de combustión exceso por ciento.[5][6] Por ejemplo, aire de combustión exceso del 15 por ciento significa que 15 por ciento más que el necesario aire estequiométrico (o 115 por ciento del aire estequiométrico) está siendo utilizado.
Un punto de control de combustión puede definirse especificando el porcentaje exceso de aire (o el oxígeno) en el oxidante, o especificando el oxígeno por ciento en el producto de la combustión.[7] Un medidor de aire – combustible cociente puede ser usado para medir el oxígeno en los gases de combustión, de la cual se puede calcular el exceso de oxígeno por ciento de estequiometría por ciento y un balance de masa para la combustión del combustible. Por ejemplo, para propano)C
3H
8) combustión entre estequiométrico y 30 por ciento exceso de aire (AFRmasa entre 15,58 y 20.3), es la relación porcentual exceso de aire y oxígeno por ciento:


Véase también
- Temperatura de flama adiabática
- Sensor AFR
- Medidor de aire – combustible cociente
- Lean burn
- Sensor de flujo de masa
- Combustión
- Relación estequiométrica aire a combustible de combustibles comunes
Referencias
- ^ Hillier, V.A.W.; Pittuck, F.W. (1966). "Sub sección 3.2". Fundamentos de la tecnología del vehículo de Motor. Londres: Hutchinson educativo. ISBN0 09 110711 3.
- ^ Ver ejemplo en 15,3 Çengel, Yunus A.; Boles, Michael A. (2006). Termodinámica: Un enfoque de ingeniería (5ª Ed.). Boston: McGraw-Hill. ISBN9780072884951.
- ^ Kumfer, B.; Skeen, S.; Axelbaum, R. (2008). "Combustión y llama" 154. págs. 546-556.
|Chapter =(ignoradoAyuda) - ^ Introducción a la energía y combustible: 1) MOLES, masa, concentración y definiciones, visitado el 25 / 05 / 2011
- ^ "Consejos de energía - proceso de la calefacción". Departamento de energía de Estados Unidos, oficina de eficiencia energética y energías renovables. Noviembre de 2007. 29 de julio 2013.
|Chapter =(ignoradoAyuda) - ^ "Combustión estequiométrica y exceso de aire". La caja de herramientas de ingeniería. 29 de julio 2013.
- ^ Eckerlin, Herbert M. "406 - conservación de la energía en la industria de la ingeniería aeroespacial y mecánica". North Carolina State University. 29 de julio 2013.
|Chapter =(ignoradoAyuda)
Enlaces externos
- HowStuffWorks: inyección de combustible, convertidor catalítico
- University of Plymouth: Cartilla de combustión del motor
- Kamm, Richard W. "Confundido sobre las mezclas de combustible".. Tecnología de mantenimiento de aeronaves (Febrero de 2002). 2009-03-18.