Quimioterapia

Quimioterapia (abreviado a menudo a quimioterapia y a veces CTX o CTx) es una categoría de tratamiento del cáncer que utiliza sustancias químicas, especialmente contra el cáncer uno o más fármacos ()agentes quimioterapéuticos) que se dan como parte de un estándar régimen de quimioterapia. La quimioterapia puede administrarse con un curativo intención, o se puede apuntar para prolongar la vida o a reducir los síntomas. Junto con terapia hormonal y terapia dirigida, es una de las principales categorías de Oncología Médica (farmacoterapia para el cáncer). Estas modalidades son utilizadas a menudo en combinación con otros tratamientos para el cáncer, como terapia de radiación, cirugía, o terapia de hipertermia. Algunos medicamentos de quimioterapia se utilizan también para tratar otras afecciones, incluyendo Amyloidosis del AL, la espondilitis anquilosante, esclerosis múltiple, Enfermedad de Crohn, psoriasis, artritis psoriásica, lupus eritematoso sistémico, artritis reumatoide, y esclerodermia.
Los agentes quimioterapéuticos tradicionales actúan matando a las células que se dividen rápidamente, una de las principales características de la mayoría de las células cancerosas. Esto significa que la quimioterapia también daña las células que se dividen rápidamente en circunstancias normales: las células en el médula ósea, tracto digestivo, y folículos de pelo. Esto se traduce en los efectos secundarios más comunes de la quimioterapia: mielosupresión (disminución de la producción de células sanguíneas, por lo tanto también inmunosupresión), mucositis (inflamación de la mucosa del tracto digestivo), y alopecia (pérdida de cabello).
Algunos nuevos fármacos contra el cáncer (por ejemplo, varios anticuerpos monoclonales) no son citotóxicas indiscriminadamente, pero bastante objetivo proteínas que anormalmente se expresan en las células cancerosas y que son esenciales para su crecimiento. Estos tratamientos se refieren a menudo como terapia dirigida (no confundir con quimioterapia clásica) y a menudo se utilizan junto con los agentes quimioterapéuticos tradicionales en los regímenes de tratamiento antineoplásico.
La quimioterapia puede usar un medicamento en un tiempo (agente único quimioterapia) o varios fármacos a la vez ()quimioterapia de combinación o poliquimioterapia). La combinación de quimioterapia y radioterapia es quimiorradioterapia. Se denomina quimioterapia usando drogas que se convierten en actividad citotóxica solamente sobre la exposición a la luz Fotoquimioterapia o terapia fotodinámica.
Contenido
- 1 Historia
- 1.1 El término quimioterapia
- 2 Modo general de acción en el cáncer
- 3 Tipos
- 3.1 Agentes alquilantes
- 3.2 Anti-metabolitos
- 3.3 Agentes anti-microtúbulos
- 3.4 Inhibidores de la topoisomerasa
- 3.5 Antibióticos citotóxicos
- 4 Estrategias de tratamiento
- 5 Dosificación
- 6 Entrega
- 7 Efectos adversos
- 7.1 Inmunosupresión y mielosupresión
- 7.2 Tiflitis
- 7.3 Señal de socorro gastrointestinal
- 7.4 Anemia
- 7.5 Fatiga
- 7.6 Náuseas y vómitos
- 7.7 Pérdida de cabello
- 7.8 Neoplasma secundario
- 7.9 Infertilidad
- 7.10 Teratogenicidad
- 7.11 Neuropatía periférica
- 7.12 Deterioro cognitivo
- 7.13 Síndrome de lisis tumoral
- 7.14 Daño a los órganos
- 7.15 Otros efectos secundarios
- 8 Limitaciones
- 9 Eficacia
- 10 Resistencia
- 11 Citotóxicos y terapias dirigidas
- 12 Enfoques nuevos y experimentales
- 12.1 Terapias dirigidas
- 12.1.1 Fármacos anticuerpos conjugados
- 12.1.2 Nanopartículas
- 12.2 Electrochemotherapy
- 12.3 Terapia de hipertermia
- 12.1 Terapias dirigidas
- 13 Otros usos
- 14 PRECAUCIONES ocupacionales
- 15 En otros animales
- 16 Comparación de agentes disponibles
- 17 Véase también
- 18 Referencias
- 19 Bibliografía
- 20 Enlaces externos
Historia
El primer uso de medicamentos para tratar el cáncer fue a principios del siglo XX, aunque no estaba previsto originalmente para ese propósito. Gas mostaza fue utilizado como un guerra química agente durante I Guerra Mundial y fue descubierto para ser un potente supresor de hematopoyesis (producción de sangre).[1] Una familia de compuestos conocidos como similar mostazas de nitrógeno se estudiaron más durante SEGUNDA guerra mundial en la Universidad de Yale.[2] Fue razonó que un agente que daña los glóbulos blancos crecientes podría tener un efecto similar sobre el cáncer. Por lo tanto, en diciembre de 1942, varios pacientes con avanzado linfomas (cánceres del sistema linfático y los ganglios linfáticos) recibieron la droga por la vena, en lugar de respirar el gas irritante.[2] Su mejora, aunque temporal, fue notable.[3][4] Al mismo tiempo, durante una operación militar en la II guerra mundial, después de un alemán ataque aéreo en el puerto italiano de Bari, varios cientos de personas fueron expuestos accidentalmente el gas mostaza, que habían sido transportados allí por el Fuerzas aliadas a prepararse para posibles represalias en caso de uso alemana de la guerra química. Los sobrevivientes fueron encontrados más tarde para tener muy baja de glóbulos blancos.[5] Después de WWII terminó y los informes desclasificados, las experiencias convergían y llevaron a los investigadores a buscar otras sustancias que tengan efectos similares contra el cáncer. Fue el primer medicamento de quimioterapia que se desarrolló de esta línea de investigación mustina. Desde entonces, se han desarrollado muchos otros medicamentos para tratar el cáncer, y el desarrollo de fármacos ha explotado en una industria multimillonaria, aunque aún se aplican los principios y las limitaciones de la quimioterapia descubiertos por los investigadores tempranos.[6]
El término quimioterapia
La palabra quimioterapia sin un modificador generalmente se refiere a tratamiento contra el cáncer, pero su significado histórico era más amplio. El término fue acuñado en el año 1900 por Paul Ehrlich en el sentido de cualquier uso de productos químicos para el tratamiento de cualquier enfermedad)quimio- + -terapia), como el uso de antibióticos (quimioterapia antibacteriana).[7] Ehrlich no era optimista que se encontrarían fármacos quimioterapéuticos eficaces para el tratamiento del cáncer.[7] Fue el primer agente quimioterapéutico moderno Arsfenamina, un compuesto de arsénico descubierto en 1909 y se utiliza para tratar sífilis.[8] Esto fue seguido más tarde por sulfamidas (sulfonamidas) y penicilina. En la actualidad uso, la sentido "cualquier tratamiento de la enfermedad con las drogas" a menudo se expresa con la palabra farmacoterapia.
Modo general de acción en el cáncer

Cáncer es el crecimiento incontrolado de células junto con maligno comportamiento: invasión y metástasis (entre otras características).[9] Es causado por la interacción entre genética susceptibilidad y factores ambientales.[10][11] Estos factores conducen a las acumulaciones de mutaciones genéticas en oncogenes (genes que promueven el cáncer) y genes supresores de tumores (genes ayudan a prevenir el cáncer), que da a las células cancerosas sus malignas características, tales como crecimiento incontrolado.[12]
En el sentido más amplio, más drogas quimioterapéuticas trabajan deteriorando mitosis (división celular), objetivos con eficacia células se dividen rápidamente. Como estas drogas causan daño a las células, ellos son llamados citotóxicos. Previenen mitosis por varios mecanismos, incluyendo dañar ADN e inhibición de los mecanismos celulares involucrados en la división celular.[13][14] Una teoría sobre por qué estos fármacos eliminan las células cancerosas es que inducen una forma de muerte celular conocida como programada apoptosis.[15]
Como la quimioterapia afecta la división celular, los tumores con alta tasas de crecimiento (tales como leucemia mielógena aguda y el agresivo linfomas, incluyendo La enfermedad de Hodgkin) son más sensibles a la quimioterapia, como son sometidos una mayor proporción de las células apuntadas división celular en cualquier momento. Tasas de malignidades con un crecimiento más lento, tales como indolente linfomas, tienden a responder a la quimioterapia más modestamente.[16] Tumores de Heterogeneic también puede mostrar diferentes sensibilidades a los agentes de quimioterapia, dependiendo de las poblaciones subclonal dentro del tumor.
Tipos

Agentes alquilantes
Los agentes alquilantes son el grupo más antiguo de quimioterapia en uso hoy en día. Derivado originalmente de gas mostaza utilizado en I Guerra Mundial, ahora hay muchos tipos de agentes en uso alquilantes.[16] Se llaman así por su capacidad de alquilato muchas moléculas, incluyendo proteínas, ARN y ADN. Esta capacidad de enlazar covalente a ADN mediante su Grupo alquil es la principal causa por sus efectos contra el cáncer.[18] ADN está hecho de dos filamentos y las moléculas pueden o enlazar dos veces a una sola hebra de ADN (intrafilamentoso reticulación) o pueden obligar a una vez a ambos filamentos (reticulación intercatenarios). Si la célula intenta replicar ADN reticulado durante división celular, o intenta repararlo, las hebras de ADN se pueden romper. Esto conduce a una forma de muerte celular programada llamada apoptosis.[17][19] Agentes alquilantes funcionarán en cualquier punto en el ciclo celular y por lo tanto son conocidos como drogas independiente del ciclo celular. Por esta razón el efecto sobre la célula es dosis dependiente; la fracción de células que mueren es directamente proporcional a la dosis de droga.[14]
Los subtipos de agentes alquilantes son la mostazas de nitrógeno, nitrosoureas, tetrazines, aziridinas, cisplatins y derivados y los agentes alquilantes no-clásico. Mostazas de nitrógeno incluyen clormetina, ciclofosfamida, melfalán, clorambucilo, Ifosfamida y busulfan. Nitrosoureas incluyen N-Nitroso-N-Metilurea (MNU), carmustina (BCNU), lomustina (CCNU) y Semustine (MeCCNU), fotemustina y streptozotocin. Tetrazines incluyen dacarbacina, mitozolomide y temozolomida. Aziridinas incluyen tiotepa, mytomycin y diaziquone (AZQ). Cisplatino y derivados incluyen cisplatino, carboplatino y oxaliplatino.[18][19] Deterioran la función celular mediante la formación de enlaces covalentes con el amino, carboxilo, Sulfidrilo, y grupos fosfato en moléculas biológicamente importantes.[20] Incluyen agentes alquilantes no clásico procarbazina y hexametilmelamina.[18][19]
Anti-metabolitos

Anti-metabolitos son un grupo de moléculas que impiden la síntesis de DNA y RNA. Muchos de ellos tienen una estructura similar a los bloques de construcción de ADN y ARN. Los bloques son nucleótidos; una molécula compuesta por un nucleobase, un azúcar y un grupo fosfato. Se dividen las nucleobases purinas (guanina y adenina) y pirimidinas (citosina, timina y uracilo). Anti-metabolitos se asemejan a nucleobases o nucleósidos (un nucleótido sin el grupo fosfato), pero han alterado grupos químicos.[21] Estos fármacos ejercen su efecto bloqueando las enzimas necesarias para la síntesis de ADN o incorporándose en DNA o RNA. Mediante la inhibición de las enzimas implicadas en la síntesis de ADN, previenen la mitosis porque el ADN se puede duplicar. También, después de misincorperation de las moléculas en el ADN, Daños en el ADN puede ocurrir y (muerte celular programadaapoptosis) es inducida. A diferencia de agentes alquilantes, anti-metabolitos son dependientes de ciclo celular. Esto significa que sólo funcionan durante una parte específica del ciclo celular, en este caso Fase S (la fase de síntesis de ADN). Por esta razón, en cierta dosis, las mesetas de efecto y proporcionalmente no más muerte celular se produce con mayores dosis. Subtipos de los anti-metabolitos son la anti-folatos, fluoropirimidinas, análogos de suministro y tiopurinas.[18][21]
Los anti-folatos incluyen metotrexato y pemetrexed. Metotrexato inhibe dihidrofolato reductasa (DHFR), una enzima que se regenera tetrahidrofolato De Dihidrofolato. Cuando la enzima es inhibida por el metotrexato, disminuyen los niveles celulares de coenzimas de folato. Estos son necesarios para timidilato y producción de purina, que son esenciales para la síntesis de ADN y la división celular.[22][23] El pemetrexed es otro antimetabolita que afecta la producción de purinas y pirimidinas y por lo tanto también inhibe la síntesis de ADN. Principalmente inhibe la enzima timidilato sintasa, pero también tiene efectos sobre DHFR, aminoimidazol carboxamida ribonucleósido formyltransferase y glycinamide ribonucleotide formyltransferase.[24] Incluyen las fluoropirimidinas fluorouracilo y capecitabina. Fluorouracilo es un análogo de la nucleobase que se metaboliza en las células para formar al menos dos productos activos; 5-fluourouridine monofosfato (FUMP) y 5-fluoro-2'-desoxiuridina 5'-fosfato (fdUMP). FUMP se incorpora en el ARN y fdUMP inhibe la enzima timidilato sintasa; los que conducen a la muerte celular.[22] La capecitabina es un Profármaco del 5-fluorouracilo que se descompone en las células para producir la droga activa.[25] Los análogos de suministro incluyen citarabina, gemcitabina, decitabina, Vidaza, fludarabina, nelarabina, cladribina, clofarabina y pentostatina. Incluyen las tiopurinas tioguanina y mercaptopurina.[18][21]
Agentes anti-microtúbulos

Los agentes anti-microtúbulos son planta-derivados químicos que bloquean la división celular mediante la prevención microtúbulos función. Los microtúbulos son una importante estructura celular compuesta por dos proteínas; Α-tubulina y Β-tubulina. Son barra hueca en forma de estructuras que se requieren para la división celular, entre otras funciones celulares.[26] Los microtúbulos son estructuras dinámicas, lo que significa que están permanentemente en un estado de montaje y desmontaje. Alcaloides de la Vinca y taxanos son los dos principales grupos de agentes anti-microtúbulos, y aunque ambos grupos de drogas causan disfunción microtúbulos, sus mecanismos de acción son totalmente opuestas. Los alcaloides de la vinca previenen la formación de los microtúbulos, mientras que los taxanos evitar el desmontaje de microtúbulos. Al hacerlo, impiden que las células cancerosas completar la mitosis. Tras ello, se produce la detención del ciclo celular, que induce programado (muerte) de la célulaapoptosis).[18][27] Además, estos medicamentos pueden afectar el crecimiento de vasos sanguíneos; un proceso esencial que los tumores utilizan para crecer y metastatizar.[27]
Alcaloides de la vinca se derivan de la Bígaro de Madagascar, Catharanthus roseus (anteriormente conocido como Vinca rosea). Se unen a sitios específicos de tubulina, inhibiendo el ensamblaje de la tubulina en los microtúbulos. Los alcaloides de la vinca original son completamente naturales químicos que incluyen vincristina y vinblastina. Tras el éxito de estos fármacos, alcaloides de la vinca semisintético fueron producidas: vinorelbina, vindesine, y vinflunina.[27] Estos fármacos son ciclo celular-específica. Se unen a las moléculas de tubulina en Fase S y prevenir la formación de microtúbulos apropiado requerida para Fase M.[14]
Los taxanos son fármacos naturales y semisintéticos. El primer fármaco de su clase, paclitaxel, originalmente fue extraída de la Tejo Pacífico árbol, Taxus brevifolia. Ahora esta droga y otra en esta clase, Docetaxel, se producen semi-sintética de un químico que se encuentra en la corteza del tejo otra; Taxus baccata. Estos fármacos promoción la estabilidad de microtúbulos, impidiendo su desmontaje. Paclitaxel evita el ciclo celular en el límite del G2-M, mientras que docetaxel ejerce su efecto durante Fase S. Los taxanos presentan dificultades en la formulación como medicinas porque son poco solubles en agua.[27]
Podofilotoxina es un antineoplásico Lignan obtenidos principalmente de la Primera americana (Podophyllum peltatum) y Primera del Himalaya (Podophyllum hexandrum o Podophyllum emodi). Tiene actividad anti-microtúbulo y su mecanismo es similar a la de alcaloides de la vinca en que se unen a la tubulina, inhibiendo la formación de microtúbulos. Podofilotoxina es utilizado para producir otros dos fármacos con diferentes mecanismos de acción: etopósido y tenipósido.[28][29]
Inhibidores de la topoisomerasa

Inhibidores de la topoisomerasa son drogas que afectan la actividad de dos enzimas: Topoisomerasa I y Topoisomerasa II. Cuando la hélice doble cadena de ADN se desenrolla, durante la replicación del ADN o Transcripción, por ejemplo, el ADN no abierto adyacente vientos más apretados (superenrollamientos), como la apertura de la mitad de una cuerda torcida. El estrés causado por este efecto es ayudado en parte por las enzimas de la topoisomerasa. Producen o doble-monocatenarias en ADN, reduciendo la tensión en el filamento de la DNA. Esto permite que la atenuación normal de ADN que ocurren durante replicación o Transcripción. Inhibición de la Topoisomerasa I o II interfiere con ambos de estos procesos.[30][31]
Dos Topoisomerasa I inhibidores, irinotecan y topotecán, se derivan semi-sintética camptotecina, que se obtiene del árbol ornamental chino Camptotheca acuminata.[14] Medicamentos que atacan la topoisomerasa II pueden dividirse en dos grupos. Venenos de la topoisomerasa II causa aumentada los niveles de enzimas atadas al ADN. Esto evita que la replicación del ADN y Transcripción, provoca roturas del filamento de ADN y conduce a (muerte celular programadaapoptosis). Estos agentes incluyen etopósido, doxorrubicina, Mitoxantrona y tenipósido. El segundo grupo, inhibidores de catalizadores, es fármacos que bloquean la actividad de la topoisomerasa II y por lo tanto evitar la síntesis de ADN y traducción porque el ADN no puede relajarse adecuadamente. Este grupo incluye novobiocina, merbarone, y aclarubicin, que también tienen otros importantes mecanismos de acción.[32]
Antibióticos citotóxicos
Los antibióticos citotóxicos son un variado grupo de fármacos que tienen varios mecanismos de acción. El grupo incluye el antraciclinas y otras drogas incluyendo Actinomicina, bleomicina, plicamicina, y mitomicina. Doxorrubicina y daunorrubicina fueron las dos primeras las antraciclinas y se obtuvieron de la bacteria Streptomyces peucetius. Derivados de estos compuestos incluyen epirubicina y idarubicina. Otros fármacos de uso clínico en el grupo anthracyline son pirarubicin, aclarubicin, y Mitoxantrona. Los mecanismos de las antraciclinas incluyen Intercalación de ADN (moléculas insertar entre las dos hebras de ADN), generación de altamente reactivo radicales libres ese daño moléculas intercelulares y la inhibición de la topoisomerasa.[33] Actinomicina es una molécula compleja que intercala ADN y previene Síntesis de ARN.[34] Bleomicina, un glucopéptido aislados de Mezcla de streptomyces, también intercala ADN, pero produce radicales libres ADN de ese daño. Esto ocurre cuando la bleomicina se une a un iones metálicos, se convierte en químicamente reducido y reacciona con oxígeno.[35][36] La mitomicina es un antibiótico citotóxico con la habilidad de alquilato ADN.[37]
Estrategias de tratamiento
| Tipo de cáncer | Drogas | Acrónimo |
|---|---|---|
| Cáncer de mama | Ciclofosfamida, metotrexato, 5-fluorouracilo | CMF |
| Doxorrubicina, ciclofosfamida | AC | |
| La enfermedad de Hodgkin | Mustina, vincristina, procarbazina, prednisolona | MOPP |
| Doxorrubicina, bleomicina, vinblastina, dacarbacina | ABVD | |
| Linfoma no-Hodgkin | Ciclofosfamida, doxorrubicina, vincristina, prednisolona | CHULETA |
| Tumor de células germinales | Bleomicina, etopósido, cisplatino | BEP |
| Cáncer de estómago | Epirubicina, cisplatino, 5-fluorouracilo | ECF |
| Epirrubicina, cisplatino, capecitabina | ECX | |
| Cáncer de vejiga | Metotrexato, vincristina, doxorrubicina, cisplatino | MVAC |
| Cáncer de pulmón | Ciclofosfamida, doxorrubicina, vincristina, | CAV |
| Cáncer colorrectal | 5-fluorouracilo, ácido folínico, oxaliplatino | FOLFOX |
Hay una serie de estrategias en la administración de fármacos quimioterapéuticos utilizados hoy. La quimioterapia puede administrarse con un curativo intención o se puede apuntar para prolongar la vida o a paliar los síntomas.
- La quimioterapia combinada es el uso de drogas con otros tratamientos contra el cáncer, tales como terapia de radiación, cirugía o terapia de hipertermia.
- La quimioterapia de inducción es el tratamiento de primera línea de cáncer con un fármaco quimioterapéutico. Este tipo de quimioterapia se utiliza para intención curativa.[23]
- Quimioterapia de consolidación se administra después de la remisión para prolongar el tiempo libre de enfermedad en general y mejorar la supervivencia global. El fármaco que se administra es lo mismo que la droga que alcanzaron la remisión.[23]
- La quimioterapia de intensificación es idéntica a la quimioterapia de consolidación pero un medicamento diferente que se utiliza la quimioterapia de inducción.[23]
- Quimioterapia de combinación consiste en tratar a un paciente con un número de diferentes fármacos al mismo tiempo. Las drogas difieren en su mecanismo y efectos secundarios. La ventaja más grande es minimizar las posibilidades de desarrollo a cualquier agente de una resistencia. También, los medicamentos a menudo pueden ser utilizados en dosis más bajas, reducir su toxicidad.[23][38]
- Neoadyuvante la quimioterapia se administra antes de un tratamiento local como la cirugía y está diseñada para reducir el tamaño del tumor primario.[23] También se da a los cánceres con un alto riesgo de enfermedad micrometastásica.[39]
- Quimioterapia adyuvante se da después de un tratamiento local (radioterapia o cirugía). Puede ser utilizado cuando hay poca evidencia de cáncer presente, pero hay riesgo de recurrencia.[23] También es útil para matar cualquier célula cancerosa que se ha diseminado a otras partes del cuerpo. Estos micrometástasis pueden ser tratados con quimioterapia adyuvante y puede reducir las tasas de recaída causadas por estas células diseminadas.[40]
- Mantenimiento la quimioterapia es un tratamiento de dosis bajas repetido para prolongar la remisión.[23]
- Quimioterapia de salvamento o quimioterapia paliativa se da sin intención curativa, sino simplemente para disminuir la carga tumoral y aumentar la esperanza de vida. Para estos regímenes, en general, se espera un mejor perfil de toxicidad.[23]
Todos los regímenes de quimioterapia requieren que el paciente sea capaz de someterse a tratamiento. Estado de funcionamiento a menudo se utiliza como una medida para determinar si un paciente puede recibir quimioterapia, o si es necesaria la reducción de la dosis. Porque sólo una fracción de las células de un tumor morir con cada tratamiento (matar fraccional), repitió la dosis deben ser administradas para seguir reduciendo el tamaño del tumor.[41] Los regímenes de quimioterapia actual aplicarán tratamiento farmacológico en ciclos, con la frecuencia y duración de tratamientos limitados por toxicidad para el paciente.[42]
Dosificación

Dosificación de la quimioterapia puede ser difícil: Si la dosis es demasiado baja, será ineficaz contra el tumor, mientras que, en dosis excesivas, la toxicidad (efectos secundarios) será intolerable para el paciente.[16] El método estándar de determinar la dosificación de la quimioterapia se basa en calculado área de superficie corporal (BSA). La BSA generalmente se calcula con una fórmula matemática o un Nomograma, utilizando el peso y la estatura del paciente, en lugar de dirigir por medición del cuerpo masivo. Esta fórmula fue originalmente derivó en un estudio de 1916 e intentó traducir dosis medicinales establecidas con animales de laboratorio a dosis equivalentes para los seres humanos.[43] El estudio incluyó sólo 9 sujetos humanos.[44] Cuando la quimioterapia se introdujo en la década de 1950, la fórmula de BSA fue adoptada como el estándar oficial para la dosificación de la quimioterapia por falta de una mejor opción.[45][46]
Recientemente, se ha cuestionado la validez de este método en el cálculo de dosis uniformes. La razón de esto es que la fórmula sólo tiene en cuenta, altura y peso del individuo. Separación y absorción de la droga están influenciadas por múltiples factores, incluyendo la edad, género, metabolismo, estado de la enfermedad, la función del órgano, a-fármacos interacciones, genética y la obesidad, que tiene un impacto importante en la actual concentración de la droga en el torrente sanguíneo del paciente.[45][47][48] Como resultado, hay gran variabilidad en la concentración de fármaco de quimioterapia sistémica entre pacientes dosificadas por BSA, y esta variabilidad ha demostrado ser más de diez veces para muchas drogas.[44][49] En otras palabras, si dos de los pacientes reciben la misma dosis de un medicamento determinado basado en BSA, la concentración de esa droga en el torrente sanguíneo de un paciente puede ser 10 veces más alta o más baja comparados con la de otro paciente.[49] Esta variabilidad es típica con muchos fármacos de quimioterapia dosificadas por BSA y, como se muestra abajo, fue demostrada en un estudio de 14 medicamentos de quimioterapia comunes.[44]
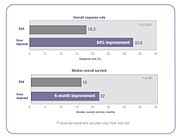
El resultado de esta variabilidad farmacocinética entre los pacientes es que muchos pacientes no reciben la dosis correcta para lograr la efectividad de un tratamiento óptimo con reducida al mínimo efectos secundarios tóxicos. Algunos pacientes son una sobredosis mientras que otros son underdosed.[45][47][48][50][51][52][53] Por ejemplo, en un ensayo clínico aleatorizado, los investigadores encontraron el 85% de pacientes con cáncer colorrectal metastásico tratados con 5-fluorouracilo (5-FU) no recibió la dosis terapéutica óptima cuando dosificadas por el estándar de BSA, 68% fueron underdosed y 17% fueron una sobredosis.[50]
Ha habido reciente controversia sobre el uso de BSA para calcular las dosis de quimioterapia para obeso pacientes.[54] Debido a su mayor BSA, los médicos a menudo arbitrariamente reducen la dosis prescrita por la fórmula de BSA para temor de sobredosificación.[54] En muchos casos, esto puede resultar en un tratamiento óptimo.[54]
Varios estudios clínicos han demostrado que cuando es quimioterapia dosis individualizada para lograr exposición sistémica óptima de la droga, se mejoran los resultados del tratamiento y se reducen los efectos secundarios tóxicos.[50][52] En el estudio clínico de 5-FU citado más arriba, los pacientes cuya dosis fue ajustada para lograr una exposición objetivo predeterminado se dio cuenta de una mejora del 84% en la tasa de respuesta del tratamiento y una mejora de seis meses en la supervivencia general (SG) en comparación con las dosis por BSA.[50]


En el mismo estudio, los investigadores compararon la incidencia de la toxicidad asociada a 5-FU grado 3/4 común entre los pacientes dosis ajustada y los pacientes BSA de dosificado.[50] La incidencia de debilitante grados de diarrea se redujo de 18% en el grupo de dosificado BSA al 4% en el grupo de dosis ajustadas de los pacientes y los efectos secundarios hematológicos graves fueron eliminados.[50] Debido a la toxicidad reducida, ajustados a la dosis de los pacientes pudieron ser tratados durante largos períodos de tiempo.[50] BSA-dosificado pacientes fueron tratados por un total de 680 meses mientras que trataron pacientes dosis ajustada para un total de 791 meses.[50] Completar el curso del tratamiento es un factor importante en el logro de mejores resultados de tratamiento.
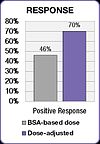
Resultados similares fueron encontrados en un estudio con pacientes de cáncer colorrectal tratados con el popular FOLFOX régimen.[52] La incidencia de diarrea grave se redujo de 12% en el grupo de pacientes BSA dosificado a 1,7% en el grupo de dosis ajustada, y la incidencia de la mucositis severo se redujo de 15% a 0,8%.[52]
El estudio FOLFOX también demostró una mejoría en los resultados del tratamiento.[52] Respuesta positiva aumentó de 46% en los pacientes de BSA de dosificado al 70% en el grupo de dosis ajustada. La supervivencia libre de progresión de la mediana (PFS) y la supervivencia global (SG) mejoraron por seis meses en el grupo de dosis ajustada.[52]
Un enfoque que puede ayudar a los médicos a individualizar la dosificación de la quimioterapia es medir los niveles de la droga en el plasma sanguíneo con el tiempo y ajustar la dosis de acuerdo con una fórmula o algoritmo para lograr la exposición óptima. Con un objetivo establecido exposición para la efectividad del tratamiento optimizado con toxicidades minimizadas, dosificación puede personalizarse para lograr objetivo exposición y resultados óptimos para cada paciente. Tan un algoritmo fue utilizado en los ensayos clínicos antes citada y dio lugar a los resultados del tratamiento mejoró significativamente.
Oncólogos ya están individualizando la dosificación de algunos fármacos contra el cáncer basados en la exposición. Carboplatino[55] y busulfan[56][57] dosificación dependen de los resultados de exámenes de sangre para calcular la dosis óptima para cada paciente. Simples análisis de sangre también están disponibles para la optimización de dosis de metotrexato,[58] 5-FU, paclitaxel, y Docetaxel.[59][60]
Entrega

La mayoría de la quimioterapia es entregado por vía intravenosa, aunque un número de agentes puede administrarse por vía oral (por ejemplo, melfalán, busulfan, capecitabina).
Existen muchos métodos intravenosos del fármaco, conocido como dispositivos de acceso vascular. Estos incluyen la dispositivo de infusión alado, cánula periférica, catéter de línea media, catéter central insertado periféricamente (PICC), catéter venoso central y Puerto implantable. Los dispositivos tienen diferentes aplicaciones en cuanto a la duración del tratamiento con quimioterapia, método de envío y tipos de agentes quimioterapéuticos.[61]
Dependiendo del paciente, el cáncer, la etapa del cáncer, el tipo de quimioterapia y la dosis, puede administrarse quimioterapia intravenosa ya sea un para pacientes hospitalizados o un para pacientes ambulatorios base. Para la administración de quimioterapia intravenosa continua, frecuente o prolongado, varios sistemas pueden insertarse quirúrgicamente en la vasculatura de mantener el acceso.[62] Sistemas comúnmente utilizados son el Línea de Hickman, la Port-a-Cathy el Línea PICC. Éstos tienen un menor riesgo de infección, son mucho menos propensos a flebitis o extravasacióny eliminar la necesidad de inserción repetida de cánulas periféricas.[citación necesitada]
Perfusión aislada de la extremidad (a menudo se utiliza en melanoma),[63] o infusión aislada de la quimioterapia en el hígado[64] o el pulmón se han utilizado para el tratamiento de algunos tumores. El propósito principal de estos enfoques es entregar una dosis muy alta de quimioterapia a sitios de tumor sin causar daño sistémico abrumadora.[65] Estos enfoques pueden ayudar a control metástasis solitaria o limitada, pero son por definición no sistémica y, por lo tanto, no tratar las metástasis distribuidas o micrometástasis.
Quimioterapia tópica, tales como 5-fluorouracilo, se utilizan para tratar algunos casos de cáncer de piel no melanoma.[66]
Si el cáncer ha sistema nervioso central participación, o con enfermedad meníngea, intratecal la quimioterapia puede ser administrada.[16]
Efectos adversos
Quimioterapéuticos las técnicas tienen una gama de efectos secundarios que dependen del tipo de medicamentos que se usan. Los medicamentos más comunes afectan principalmente el células se dividen rápidamente del cuerpo, tales como células de la sangre y las células que recubren la boca, el estómago y los intestinos. Quimioterapia relacionados con la toxicidad puede ocurrir agudo después de la administración, dentro de horas o días, o crónico, desde semanas hasta años.[67]
Inmunosupresión y mielosupresión
Prácticamente todos los regímenes de quimioterapia pueden causar la depresión de la sistema inmune, a menudo por la paralización de la médula ósea y que conduce a una disminución de glóbulos blancos, glóbulos rojos, y plaquetas. Anemia y trombocitopenia, cuando ocurren, se mejoran con transfusión de sangre. Neutropenia (una disminución de la granulocitos neutrófilos cuenta debajo de 0.5 x 109/litro) puede mejorarse con sintético G-CSF (colonias de granulocitos-Colonia-factor, por ejemplo, estimulante filgrastim, lenograstim).
En muy grave mielosupresión, que se produce en algunos regímenes, casi todos de la médula ósea células madre (células que producen Blanco y glóbulos rojos) son destruidas, lo que significa alógeno o autólogo trasplantes de células de médula ósea son necesarios. (En BMTs autólogos, células se extraen del paciente antes del tratamiento, se multiplicaron y luego reinyectada después; alógeno BMTs, la fuente es un donante). Sin embargo, algunos pacientes desarrollan aún enfermedades debido a esta interferencia con la médula ósea.
Aunque los pacientes son alentados a lavarse las manos, evitar los enfermos y tomar otras medidas de reducción de la infección, alrededor del 85% de las infecciones son debido a que ocurren naturalmente microorganismos en el paciente tracto gastrointestinal (incluyendo cavidad bucal) y la piel.[68] Esto puede manifestarse como infecciones sistémicas, tales como sepsis, o como localizada brotes, tales como Herpes simple, Tejas, u otros miembros de la Herpesviridea.[69] A veces, tratamientos de quimioterapia se pospusieron porque el sistema inmune se suprime a un nivel peligrosamente bajo.
En Japón, el gobierno ha aprobado el uso de algunas hongos medicinales como Trametes versicolor, para contrarrestar la depresión del sistema inmune en pacientes sometidos a quimioterapia.[70]
Tiflitis
Debido a la supresión del sistema inmunológico, Tiflitis es una "complicación potencialmente mortal gastrointestinal de la quimioterapia."[71] Tiflitis es una infección intestinal que puede manifestarse a través de síntomas incluyendo náuseas, vómitos, diarrea, un abdomen distendido, fiebre, escalofríos, o sensibilidad y dolor abdominal.
Tiflitis es un emergencia médica. Tiene un muy pobre pronóstico y es a menudo fatal a menos que reconocer con prontitud y tratar agresivamente.[72] Tratamiento exitoso depende del diagnóstico precoz proporcionado por un alto índice de sospecha y el uso del tratamiento conservador, escaneo CT para casos sencillos y a veces electiva hemicolectomía para prevenir la recurrencia.[72]
Señal de socorro gastrointestinal
Náuseas, vómitos, anorexia, diarrea, calambres abdominales, y estreñimiento son comunes los efectos secundarios de los medicamentos quimioterapéuticos que matan a las células se dividen rápidamente.[73] Desnutrición y deshidratación puede producirse cuando el paciente no coma ni beba lo suficiente, o cuando el paciente vomita con frecuencia, debido al daño gastrointestinal. Esto puede resultar en pérdida de peso rápida, u ocasionalmente en la ganancia de peso, si el paciente come demasiado en un esfuerzo por aliviar las náuseas o ardor de estómago. Aumento de peso también puede ser causada por algunos medicamentos esteroides. Estos efectos secundarios pueden reducirse o eliminarse con frecuencia antiemético drogas. Medidas de cuidados personales, tales como comer comidas pequeñas frecuentes y beber líquidos claros o jengibre té, a menudo se recomiendan. En general, esto es un efecto temporal y con frecuencia se resuelve dentro de una semana de tratamiento de acabado. Sin embargo, una alta Índice de la suspicacia es apropiado, desde diarrea y distensión abdominal es también síntomas de Tiflitis, una muy grave y potencialmente mortal emergencia médica requiere tratamiento inmediato.
Anemia
Anemia en el cáncer de los pacientes pueden ser un resultado combinado causado por la quimioterapia mielosupresora y relacionada con el cáncer causas posibles tales como sangrado, células de la sangre destrucción)hemólisis), enfermedad hereditaria, disfunción renal, deficiencias nutricionales o anemia de enfermedad crónica. Tratamientos para mitigar la anemia incluyen hormonas para aumentar la producción (de sangreeritropoyetina), suplementos de hierro, y transfusiones de sangre.[74][75][76] Terapia myelosuppressive puede provocar una tendencia a sangrar fácilmente, llevando a la anemia. Medicamentos que matan rápidamente divisoria o células de la sangre pueden reducir el número de plaquetas en la sangre, lo cual puede resultar en moretones y sangrado. Conteo de plaquetas muy bajas puede ser impulsado temporalmente a través de transfusiones de plaquetas y se están desarrollando nuevas drogas para aumentar el conteo de plaquetas durante la quimioterapia.[77][78] A veces, tratamientos de quimioterapia se posponen para permitir la plaqueta cuenta para recuperar.
Fatiga
Fatiga puede ser una consecuencia del cáncer o su tratamiento y puede durar por meses o años después del tratamiento. Es una de las causas fisiológica de la fatiga anemia, que puede ser causada por la quimioterapia, cirugía, radioterapia, primaria y metastática enfermedad o agotamiento nutricional.[79][80] Ejercicio anaeróbico se ha encontrado para ser beneficioso en la reducción de la fatiga en las personas con tumores sólidos.[81]
Náuseas y vómitos
Náuseas y vómitos son dos del cáncer más temido de los efectos secundarios relacionados con el tratamiento para los pacientes con cáncer y sus familias. En 1983, Coates et al encontraron que los pacientes que reciben quimioterapia clasificado náuseas y vómitos como los primeros y segundo más graves de efectos secundarios, respectivamente. Hasta 20% de los pacientes que recibieron altamente emetógena agentes en esta época pospusieron, o incluso negaron, tratamientos potencialmente curativos.[82] Inducida por la quimioterapia náuseas y vómitos (CINV) son comunes con muchos tratamientos y algunas formas de cáncer. Desde la década de 1990, varias clases de novela de antieméticos se han desarrollado y comercializado, convirtiéndose en una norma casi universal en los regímenes de quimioterapia y ayudar a gestionar con éxito estos síntomas en una gran parte de los pacientes. Mediación efectiva de estos resultados los síntomas desagradables y a veces agobiantes en mayor calidad de vida para los ciclos de tratamiento paciente y más eficiente, debido a la menor paro del tratamiento debido a mejor tolerancia por parte del paciente y mejor salud general del paciente.
Pérdida de cabello
Pérdida de cabello (Alopecia) puede ser causada por la quimioterapia que destruye las células rápidamente divisorias; otros medicamentos pueden causar caída del cabello. Estos son los efectos a menudo temporales más: cabello usualmente comienza a crecer unas semanas después del último tratamiento y a veces puede cambiar color, textura, grosor y estilo. A veces pelo tiende a encresparse después de rebrote, resultando en "rizos de quimioterapia". Pérdida del cabello severa ocurre con mayor frecuencia con las drogas tales como doxorrubicina, daunorrubicina, paclitaxel, Docetaxel, ciclofosfamida, Ifosfamida y etopósido. Pérdida de cabello o adelgazamiento permanente puede resultar de algunos regímenes de quimioterapia estándar.
Quimioterapia de pérdida de cabello inducida se produce por un mecanismo no-androgénicos y puede se manifiesta como alopecia total, Efluvio telógeno, o con menos frecuencia areata de la alopecia.[83] Se asocia generalmente con el tratamiento sistémico debido a la alta tasa mitótica de los folículos pilosos y más reversible de alopecia androgénica,[84][85] Aunque pueden ocurrir casos permanentes.[86] La quimioterapia induce la pérdida de cabello en las mujeres más a menudo que los hombres.[87]
Cuero cabelludo de enfriamiento ofrece un medio de prevenir tanto pérdida de pelo permanente y temporal, sin embargo ha manifestado preocupación por este método.[88][89]
Neoplasma secundario
Desarrollo de neoplasia secundaria después de tratamiento acertado de la quimioterapia o la radioterapia puede ocurrir. Los más comunes neoplasma secundario es la leucemia mieloide aguda secundaria, que se desarrolla principalmente después del tratamiento con agentes alquilantes o inhibidores de la topoisomerasa.[90] Sobrevivientes de cáncer infantil son más de 13 veces más probabilidades de conseguir un neoplasma secundario durante los 30 años después del tratamiento que la población general.[91] No todos de este aumento se pueden atribuir a la quimioterapia.
Infertilidad
Algunos tipos de quimioterapia son gonadotóxica y pueden causar infertilidad.[92] Las quimioterapias con alto riesgo incluyen procarbazina y otras drogas alquilantes tales como ciclofosfamida, ifosfamida, busulfan, melfalán, clorambucil y chlormethine.[92] Los fármacos con riesgo medio incluyen doxorrubicina y análogos de platino como cisplatino o carboplatino.[92] Por otro lado, los tratamientos con bajo riesgo de gonadotoxicity incluyen derivados de plantas como la vincristina y vinblastina, antibióticos como bleomicina dactinomicina y antimetabolitos como metotrexato, mercaptopurina y 5-fluorouracilo.[92]
Infertilidad femenina por la quimioterapia parece ser secundario a fallo ovárico prematuro por la pérdida de folículos primordiales.[93] Esta pérdida no es necesariamente un efecto directo de los agentes quimioterapéuticos, pero podría deberse a una mayor tasa de iniciación de crecimiento reemplazar daña los folículos en desarrollo.[93]
Los pacientes pueden elegir entre varios métodos de preservación de la fertilidad antes de la quimioterapia, incluyendo Criopreservación de semen, tejido ovárico, óvulos o embriones.[94] Como más de la mitad de los pacientes con cáncer son mayor, este efecto nocivo sólo es relevante para una minoría de pacientes. Un estudio realizado en Francia entre 1999 y 2011 vinieron al resultado ese embrión congelado antes de que la administración de agentes gonadotóxica para las hembras causó un retraso del tratamiento en 34% de los casos y un nacimiento en el 27% de sobrevivir casos que quería quedar embarazada, con el tiempo de seguimiento varía entre 1 y 13 años.[95]
En la quimioterapia como un régimen de condicionamiento en el trasplante de células madre hematopoyéticas, un estudio de pacientes condicionada ciclofosfamida sola para la anemia aplástica severa vino al resultado que la recuperación ovárica ocurrió en todas las mujeres menores de 26 años en el momento del trasplante, pero sólo en cinco de 16 mujeres mayores de 26 años.[96]
Teratogenicidad
La quimioterapia es potencialmente teratogénicos durante embarazo, especialmente durante el primer trimestre, en la medida que aborto generalmente se recomienda si el embarazo en este período se encuentra durante la quimioterapia.[97] Exposición de segundo y tercer trimestre generalmente no aumentan el riesgo teratogénico y los efectos adversos sobre el desarrollo cognitivo, pero puede aumentar el riesgo de varios complicaciones del embarazo y la mielosupresión fetal.[97]
En los machos previamente sometido a quimioterapia o radioterapia, parecen existir ningún aumento de defectos genéticos o malformaciones congénitas en sus hijos concebidos después de la terapia.[97] El uso de técnicas de reproducción asistida y técnicas de micromanipulación puede aumentar este riesgo.[97] En las hembras previamente haber sido sometido a quimioterapia, aborto y malformaciones congénitas no se aumentan en conceptos posteriores.[97] Sin embargo, cuando fertilización in vitro y embrión cryopreservationis practica entre o poco tiempo después del tratamiento, existen posibles riesgos genéticos a los ovocitos crecientes, y por lo tanto, se recomienda que los bebés se proyectará.[97]
Neuropatía periférica
Entre 30 y 40 por ciento de los pacientes sometidos a la experiencia de la quimioterapia neuropatía periférica inducida por la quimioterapia (NPIQ), un progresista, perdurable y condición a menudo irreversible, causando dolor, hormigueo, entumecimiento y sensibilidad al frío, comenzando en las manos y los pies y a veces progresa a los brazos y las piernas.[98] Incluyen fármacos de quimioterapia asociadas a NPIQ talidomida, epothilones, alcaloides de la Vinca, taxanos, inhibidores del proteosoma derivadosy los fármacos basados en platino.[98][99][100] Independientemente de que sea NPIQ y en qué grado, está determinado por la elección del fármaco, la duración de uso, la cantidad total consumida y si el paciente ya ha neuropatía periférica. Aunque los síntomas son principalmente sensoriales, en algunos casos nervios del motor y el sistema nervioso autónomo se ven afectados.[101] NPIQ a menudo sigue a la primera dosis de quimioterapia y aumenta en severidad como tratamiento continúa, pero esta progresión los niveles generalmente en la terminación del tratamiento. Los fármacos basados en platino son la excepción; con estos fármacos, sensación que continúe deteriorándose durante varios meses después del final del tratamiento.[102] Algunos NPIQ parece ser irreversible.[102] Dolor a menudo se puede controlar con medicamentos u otro tratamiento pero el entumecimiento es generalmente resistente al tratamiento.[103]
Deterioro cognitivo
Algunos pacientes reportan fatiga o problemas neurocognitivos inespecífica, como una incapacidad para concentrarse; Esto se denomina la quimioterapia posterior deterioro cognitivo, conocido como "quimio-cerebro" por grupos de pacientes.[104]
Síndrome de lisis tumoral
En tumores particularmente grandes y cánceres con alta recuentos de glóbulos blancos, tales como linfomas, teratomasy algunos leucemias, algunos pacientes desarrollan síndrome de lisis tumoral. La rápida descomposición de las células cancerosas provoca la liberación de químicos desde el interior de las células. A raíz de esto, los altos niveles de ácido úrico, potasio y fosfato se encuentran en la sangre. Niveles altos de fosfato inducen hipoparatiroidismo secundario, resultando en niveles bajos de calcio en la sangre. Esto causa daño a los riñones y pueden causar los altos niveles de potasio arritmia cardiaca. Aunque la profilaxis está disponible y a menudo se inicia en pacientes con tumores grandes, éste es un efecto secundario peligroso que puede conducir a la muerte si no se tratan.[105]
Daño a los órganos
Cardiotoxicidad (daño al corazón) es especialmente prominente con el uso de antraciclina drogas)doxorrubicina, epirubicina, idarubicina, y doxorrubicina liposomal). La causa de esto es probablemente debido a la producción de radicales libres en la celda y posterior Daños en el ADN. Otros agentes quimioterápicos que causan toxicidad cardíaca, pero en una menor incidencia, son ciclofosfamida, Docetaxel y clofarabina.[106]
Hepatotoxicidad (daños en el hígado) pueden ser causada por muchos fármacos citotóxicos. La susceptibilidad de un individuo al daño del hígado puede ser modificada por otros factores tales como el cáncer en sí, hepatitis viral, inmunosupresión y deficiencia nutricional. El daño hepático puede consistir en daño a las células del hígado, síndrome sinusoidal hepático (obstrucción de las venas en el hígado), colestasis (donde la bilis no fluye desde el hígado al intestino) y fibrosis hepática.[107][108]
Nefrotoxicidad (daño renal) puede ser causado por síndrome de lisis tumoral y también por efectos directos de espacio libre de drogas por los riñones. Diferentes drogas afectarán a diferentes partes del riñón y la toxicidad puede ser asintomática (sólo aparece en las pruebas de sangre u orina) o puede causar insuficiencia renal aguda.[109][110]
Ototoxicidad (daño al oído interno) es un efecto secundario común de drogas basado en platino que puede producir síntomas como mareos y vértigo.[111][112]
Otros efectos secundarios
Los efectos secundarios menos comunes incluyen enrojecimiento de la piel)eritema), piel uñas dañadas, una boca seca (dryxerostomía), retención de agua, y impotencia sexual. Algunos medicamentos pueden desencadenar alérgico o pseudoallergic reacciones.
Agentes quimioterapéuticos específicos se asocian con toxicidad del órgano-específicas, incluyendo enfermedades cardiovasculares(por ejemplo, doxorrubicina), enfermedad pulmonar intersticial (por ejemplo, bleomicina) y ocasionalmente neoplasma secundario (por ejemplo, MOPP terapia para la enfermedad de Hodgkin).
Limitaciones
La quimioterapia no siempre funciona, y aun cuando es útil, no puede destruir completamente el cáncer. Los pacientes con frecuencia no entienden sus limitaciones. En un estudio de pacientes que habían sido diagnosticados recientemente con incurable, cáncer en estadio 4, más de dos tercios de los pacientes con cáncer de pulmón y más de cuatro quintas partes de los pacientes con cáncer colorrectal aún creían que la quimioterapia era probable curar el cáncer.[113]
El barrera hematoencefálica plantea un difícil obstáculo para pasar a entregar la quimioterapia para el cerebro. Esto es porque el cerebro tiene un amplio sistema para protegerlo contra químicos nocivos. Los transportadores de drogas pueden bombear drogas desde el cerebro y células de vasos sanguíneos del cerebro en el líquido cefalorraquídeo y la circulación sanguínea. Estos transportadores bombear más fármacos de quimioterapia, que reduce su eficacia para el tratamiento de tumores cerebrales. Solamente una pequeña lipofílico agentes alquilantes tales como lomustina o temozolomida son capaces de cruzar esta barrera hemato encefálica.[114][115][116]
Vasos sanguíneos en los tumores son muy diferentes de los observados en los tejidos normales. A medida que crece un tumor, las células del tumor más lejos lejos de los vasos sanguíneos se convierten en bajas en oxígeno (hipóxica). Para contrarrestar esta situación señalan para que nuevos vasos sanguíneos crecer. La vasculatura tumoral recién formado está mal formada y no entregar un suministro adecuado de sangre a todas las áreas del tumor. Esto conduce a problemas con el suministro de medicamentos porque muchos medicamentos serán entregados al tumor por la sistema circulatorio.[117]
Eficacia
La eficacia de la quimioterapia depende del tipo de cáncer y la etapa. Las gamas de efectividad general de ser curativa para algunos tipos de cáncer, como algunos leucemias,[118][119] a ser ineficaz, tales como en algunos tumores cerebrales,[120] a ser innecesaria en otros, como la mayoría cánceres de piel no melanoma.[121]
Incluso cuando es imposible para la quimioterapia proporcionar una curación permanente, la quimioterapia puede ser útil para reducir los síntomas como el dolor o reducir el tamaño de un tumor inoperable en la esperanza de que la cirugía será posible en el futuro.
Resistencia
Resistencia es una causa importante del fracaso del tratamiento de drogas quimioterapéuticas. Existen algunas causas posibles de la resistencia en el cáncer, una de ellas es la presencia de bombas pequeñas en la superficie de las células cancerosas que se mueven activamente quimioterapia desde dentro de la célula hacia el exterior. Las células cancerosas producen grandes cantidades de estas bombas, conocidas como p-glicoproteína, con el fin de protegerse de la quimioterapia. Investigación sobre p-glicoproteína y otros tales bombas de eflujo de quimioterapia está actualmente en curso. Medicamentos para inhibir la función de p-glicoproteína están sometidos a investigación, pero debido a la toxicidad y las interacciones con fármacos contra el cáncer, su desarrollo ha sido difícil.[122][123] Otro mecanismo de resistencia es amplificación del gen, un proceso en el cual múltiples copias de un gen son producidas por las células cancerosas. Esto supera el efecto de los fármacos que reducen la expresión de los genes involucrados en la replicación. Con más copias del gen, la droga no puede evitar que toda la expresión del gen y, por tanto, la célula puede restaurar su capacidad proliferativa. Las células cancerosas también pueden causar defectos en las vías celulares de apoptosis (muerte celular programada). Como la mayoría de las drogas de quimioterapia eliminan las células cancerosas de esta manera, apoptosis defectuoso permite la supervivencia de estas células, haciéndolos resistentes. Muchos fármacos de quimioterapia también causan daños en el ADN, que pueden ser reparada por enzimas en la celda que llevan a cabo Reparación del ADN. Upregulation de estos genes puede superar el daño del ADN y evitar la inducción de apoptosis. Mutaciones en los genes que producen proteínas blanco drogas, tales como tubulina, puede ocurrir que previenen las drogas del enlace a la proteína, conduce a la resistencia a los medicamentos.[124]
Citotóxicos y terapias dirigidas
Terapias dirigidas son un tipo relativamente nuevo de fármacos contra el cáncer que puede superar muchos de los problemas considerados el uso de citotóxicos. Están divididos en dos grupos: molécula pequeña y anticuerpos. La toxicidad masiva considerada el uso de citotóxicos es debido a la falta de especificidad celular de las drogas. Van a matar cualquier célula rápidamente divisoria, tumor o normal. Terapias dirigidas están diseñadas para afectar proteínas celulares o procesos que son utilizados por las células cancerosas. Esto permite una alta dosis a los tejidos de cáncer con una dosis relativamente baja a otros tejidos. Como diversas proteínas son utilizadas por tipos diferentes de cáncer, se utilizan los medicamentos de terapia dirigida en un tipo de cáncer específico, ni siquiera en forma paciente específico. Aunque el efectos secundarios suelen ser menos grave que visto de quimioterapia citotóxica, pueden ocurrir efectos mortales. Inicialmente, la terapéutica específica debían para ser exclusivamente selectivo para una proteína. Ahora es claro que a menudo existe una amplia gama de objetivos de proteína que el fármaco puede atar. Un ejemplo para la terapia dirigida es la proteína producida por el Cromosoma Filadelfia, una lesión genética encontrada comúnmente en leucemia mielomonocítica crónica. Esta proteína de fusión tiene actividad enzimática que puede ser inhibida por imatinib, un molécula pequeña droga.[125][126][127][128]
Enfoques nuevos y experimentales

Terapias dirigidas
Especialmente dirigidos entrega vehículos pretende incrementar los niveles de efectivos de la quimioterapia de las células tumorales reduciendo niveles efectivos de otras células. Esto debe resultar en una menor toxicidad matar tumores aumentado.[129]
Fármacos anticuerpos conjugados
Fármacos anticuerpos conjugados (ADCs) comprenden un anticuerpo, droga y un enlazador entre ellos. El anticuerpo estará dirigido a una proteína preferencial expresada en las células del tumor (conocido como un antígeno tumoral) o en las células que puede utilizar el tumor, tales como vasos sanguíneos células endoteliales. Ellos se unen a los antígenos del tumor y se interioriza, donde el vinculador libera la droga dentro de la célula. Estos vehículos especialmente dirigidas entrega varían en su estabilidad, selectividad y elección de objetivo, pero, en esencia, todos ellos tienen como objetivo aumentar la dosis efectiva máxima que puede ser entregada a las células del tumor.[130] Reduce la toxicidad sistémica significa que también pueden utilizarse en los pacientes más enfermos, y que pueden transportar a nuevos agentes quimioterapéuticos que habría sido demasiado tóxicos para entregar mediante enfoques sistémicos tradicionales.[citación necesitada]
Fue el primer fármaco aprobado de este tipo Gemtuzumab ozogamicina (Mylotarg), lanzado por Wyeth (ahora Pfizer). El medicamento fue aprobado para el tratamiento de leucemia mieloide aguda, pero ahora ha sido retirada del mercado porque la droga no cumplía los objetivos de eficacia en ensayos clínicos adicionales.[131][132] Otros dos fármacos, Trastuzumab emtansine y brentuximab vedotin, son ambos en ensayos clínicos de tarde y el último se ha concedido aceleró la aprobación para el tratamiento de refractarios Linfoma de Hodgkin y sistémico linfoma anaplásico de células grandes.[130]
Nanopartículas
Nanopartículas son 1-1000 nanómetro (nm) tamaño de partículas que pueden promover la selectividad del tumor y ayudar en la entrega de baja-solubilidad drogas. Las nanopartículas pueden ser blanco de forma pasiva o activa. Orientación pasivo explota la diferencia entre los vasos sanguíneos de tumor y los vasos sanguíneos normales. Los vasos sanguíneos en los tumores son "agujereados" porque tienen huecos desde 200-2000 nm, que permiten a las nanopartículas escapar en el tumor. Orientación activa usa (moléculas biológicasanticuerpos, proteínas, ADN y ligandos del receptor) para el objetivo preferencial las nanopartículas a las células del tumor. Hay muchos tipos de sistemas de administración de nanopartículas, tales como sílice, polímeros, liposomas y partículas magnéticas. Nanopartículas de material magnético pueden utilizarse también para concentrar a agentes en sitios de tumor usando un campo magnético aplicado externamente.[129] Han surgido como un vehículo útil para agentes poco solubles tales como paclitaxel.[133]
Electrochemotherapy
Electrochemotherapy es el tratamiento combinado en el que la inyección de un fármaco quimioterapéutico es seguida por aplicación de pulsos eléctricos de alto voltaje localmente al tumor. El tratamiento permite que los fármacos quimioterapéuticos, que de lo contrario no o apenas ir a través de la membrana de las células (por ejemplo, cisplatino y bleomicina), para entrar en las células cancerosas. Por lo tanto, se logra una mayor eficacia del tratamiento antitumoral.
Electrochemotherapy clínico se ha utilizado con éxito para el tratamiento de tumores cutáneos y subcutáneos independientemente de su origen histológico.[134][135][136][137][138][139][140] El método se ha divulgado como segura, simple y altamente efectiva en todos los informes sobre el uso clínico de la electrochemotherapy. Según el proyecto ESOPE (procedimientos operativos estándar europeo de Electrochemotherapy), se elaboraron los procedimientos operativos estándar (SOP) para electrochemotherapy, basado en la experiencia de los principales centros de cáncer europeo en electrochemotherapy.[136][141] Recientemente, se han desarrollado nuevas modalidades de electrochemotherapy para el tratamiento de tumores internos mediante procedimientos quirúrgicos, rutas endoscópicas o percutáneos enfoques para obtener acceso a la zona de tratamiento.[142][143]
Terapia de hipertermia
Terapia de hipertermia es el tratamiento térmico para el cáncer que puede ser una poderosa herramienta cuando se utiliza en combinación con quimioterapia (thermochemotherapy) o radioterapia para el control de una variedad de cánceres. El calor puede aplicarse localmente en el sitio del tumor, que se dilatan los vasos sanguíneos del tumor, permitiendo más medicamentos quimioterapéuticos entrar en el tumor. Además, la capa de bi-lípidos de la membrana de la célula tumoral se convertirá en más porosa, permitiendo además más del medicamento quimioterapéutico para entrar en la célula tumoral.
Hipertermia también se ha demostrado para ayudar a prevenir o revertir "quimio-resistencia". Resistencia a la quimioterapia a veces desarrolla horas extras como los tumores se adaptan y pueden superar la toxicidad de los medicamentos de quimioterapia. "Superar la quimiorresistencia ha sido extensamente estudiada en el pasado, especialmente utilizando células CDDP-resistentes. Con respecto a los beneficios potenciales que las células resistentes a drogas pueden ser reclutadas para la terapia eficaz mediante la combinación de quimioterapia con hipertermia, era importante Mostrar la quimiorresistencia contra varios fármacos antineoplásicos (e.g. la mitomicina C, antraciclinas, BCNU, melfalán) incluyendo CDDP podría revertirse al menos parcialmente por la adición de calor.[144]
Otros usos
Algunos medicamentos de quimioterapia son utilizados en las enfermedades que no sea cáncer, tales como en desordenes autoinmunes,[145] y no cancerosos discrasia de células plasmáticas. En algunos casos a menudo se utilizan en dosis más bajas, lo que significa que se minimizan los efectos secundarios.[145] Metotrexato se utiliza en el tratamiento de artritis reumatoide (RA),[146] psoriasis,[147] la espondilitis anquilosante[148] y esclerosis múltiple.[149][150] La respuesta antiinflamatoria en RA es probablemente debido a aumentos en adenosina, cuyas causas inmunosupresión; efectos inmuno-reguladoras ciclooxigenasa-2 vías de la enzima; reducción en proinflamatorias citoquinas; y propiedades anti proliferativa.[146] Aunque el metotrexato se utiliza para tratar la esclerosis múltiple y la espondilitis anquilosante, su eficacia en estas enfermedades es aún incierto.[148][149][150] Ciclofosfamida a veces se usa para tratar nefritis lúpica, un síntoma común de lupus eritematoso sistémico.[151] Dexametasona junto con cualquiera bortezomib o melfalán es comúnmente usado como un tratamiento para el Amyloidosis del AL. Recientemente, bortezomid en combinación con ciclofosfamida y dexametasona también ha mostrado prometedora como tratamiento para la amiloidosis AL. Otros medicamentos utilizados para tratar mieloma tales como lenalidomida han mostrado prometedora en el tratamiento de la amiloidosis AL.
También se utilizan fármacos de quimioterapia en regímenes de acondicionamiento antes de hueso marow trasplante)trasplante de células madre hematopoyéticas). Los regímenes de acondicionamiento se utilizan para suprimir el sistema inmune del receptor para permitir un trasplante a engraft. Ciclofosfamida es una droga citotóxica común utilizada de esta manera y a menudo se utiliza en conjunción con irradiación corporal total. Medicamentos quimioterapéuticos pueden utilizarse en dosis altas para eliminar permanentemente las células de médula ósea del receptor (condicionamiento myeloablative) o en dosis más bajas que evitará la pérdida permanente de la médula (non-myeloablative y acondicionamiento de intensidad reducida).[152]
PRECAUCIONES ocupacionales
Trabajadores de la salud expuestos a agentes antineoplásticos toman las precauciones para mantener su exposición a un mínimo. Existe una limitación en la disolución de citotóxicos en Australia y los Estados Unidos a 20 disoluciones por su farmacéutico, enfermera,[citación necesitada] puesto que los farmacéuticos que preparan estas drogas o enfermeras que pueden preparar o administrarlos son los dos grupos ocupacionales con la más alta posible exposición a agentes antineoplásicos. Además, los médicos y personal de quirófano también puede estar expuesto a través del tratamiento de los pacientes. Personal del hospital, como el envío y recepción de personal, los trabajadores privativas de la libertad, trabajadores de las lavanderías y manipuladores de residuos, todos tiene potencial de exposición a estos fármacos durante el transcurso de su trabajo. El creciente uso de agentes antineoplásicos en Oncología veterinaria también pone estos trabajadores en riesgo de exposición a estos medicamentos.[153] Rutas de entrada al cuerpo de los usuarios son la absorción de la piel, inhalación y ingestión. Los efectos a largo plazo de la exposición incluyen anormalidades cromosómicas y infertilidad.[154]
En otros animales
La quimioterapia se utiliza en medicina veterinaria similar a cómo se utiliza en medicina humana.[155]
Comparación de agentes disponibles
| Agentes antineoplásicos | |||||||
|---|---|---|---|---|---|---|---|
| INN | Comentarios | Clasificación química | Preg. gato. | Ruta[156] | Mecanismo de acción[156][157][158][159] | Indicaciones[156][157][159] | Principales toxicidades[156][157][159][160] |
| 1. citotóxicos antineoplásicos | |||||||
| 1.01 análogos de los nucleósidos | |||||||
| Azacitidina | [161][162][163][164] [165][166][167] [168][169][170] |
Citidina analógico | X (Au) | SC, IV | Metiltransferasa de ADN inhibidor y se incorpora en el ARN, por lo tanto, inhibición de la expresión génica.[171] | Síndromes mielodisplásicos, leucemia mieloide aguda y leucemia mieloide crónica | Mielosupresión, insuficiencia renal (raro/raro), acidosis tubular renal y hipocaliemia. |
| Capecitabina | [172][173][174] [175][176][177] [178][179][180] |
Uracilo analógico | D (Au) | PO | Fluorouracilprodrug | Mama, colorrectal, gástrico y cáncer esofágico | Mielosupresión, cardiotoxicidad, hipertrigliceridemiaHemorragia GI (poco común), síndrome cerebeloso (poco común), encefalopatía (poco común) y la diarrea. |
| Carmofur | N / A | Uracilo analógico | N / A | PO | Fluorouracilo Profármaco | Colorrectal, de mama y de ovario | Mielosupresión, neurotoxicidad y la diarrea. |
| Cladribina | MS: [181][182][183] [184][185][186] [187][188][189] [190] Cáncer: [182][191][192] [193] |
Adenosina analógico | D (Au) | PO, SC, IV | ADN methyltransferaseinhibitor, metabolitos se incorporan en el ADN.[194] | Leucemia de células pilosas, leucemia linfocítica crónica, Macroglobulinemia de Waldenstrom y esclerosis múltiple. | Mielosupresión, anemia hemolítica (poco común), neurotoxicidad (rara), insuficiencia renal (rara), pulmonar intersticial infiltra (raro), Síndrome de Stevens – Johnson (raro) y necrólisis epidérmica tóxica (rara vez). |
| Clofarabina | [195][196][197] [198][199][200] [201][202][203] |
Deoxyadenosineanalogue | D (Au) | IV | Reductasa ribonucleótido y ADN polimerasa inhibidor.[204] | Leucemia linfoblástica aguda y leucemia mieloide aguda | Mielosupresión, hipocaliemia, síndrome de liberación de citoquinas, Síndrome de Stevens – Johnson(poco común), necrólisis epidérmica tóxica (poco común) y pancreatitis (poco común) |
| Citarabina | [205][206][207] | Citidina analógico | D (Au) | SC, IM, IV, | ADN polimerasa inhibidor de fase S específica. Incorpora sus metabolitos en el ADN. | Leucemia mieloide aguda, leucemia linfoblástica aguda, leucemia mieloide crónica, linfomas, leucoencephalopathy multifocal progresiva y la leucemia meníngea | Mielosupresión, Sangrado GI, pancreatitis (raro/raro), anafilaxia (raro/raro), pericarditis (raro/raro) y conjuntivitis (raro/raro). Dosis alta: disfunción cerebral y cerebelosa, ulceración GI severa toxicidad ocular, toxicidad pulmonar y neuropatía periférica (rara vez). |
| Decitabina | [161][162][208] [209][210][211] [212][213][214] [215][216] |
Citidina analógico. | D (LOS E.E.U.U.) | IV | Inhibidor de la metiltransferasa de ADN. | Síndrome mielodisplásico, anemia de células falciformes (huérfano), leucemia mieloide aguda y leucemia mieloide crónica. | Mielosupresión, hiperglucemia, Hipoalbuminemia, hipomagnesemia, hipocaliemia, hiperpotasemia y trombocitopenia. |
| Floxiridina | [217] | Uracilo analógico | D (LOS E.E.U.U.) | IA | Fluorouracilo analógico. | GI adenocarcinoma y estómago cáncer metastásico | Mielosupresión. |
| Fludarabina | [218][219][220] [220][221][222] [223] |
Adenosina analógico | D (Au) | PO, IV | ADN polimerasa y reductasa ribonucleótido inhibidor. | Leucemia mieloide aguda, leucemia linfocítica crónica, linfoma no Hodgkin y Macroglobulinemia de Waldenstrom. | Mielosupresión, hiperglucemiaGI sangra (poco común), neumonitis (poco común), anemia hemolítica (poco común), neurotoxicidad severa (rara), cistitis hemorrágica (raro), Síndrome de Stevens – Johnson (raro) y Necrólisis epidérmica tóxica (rara vez). |
| Fluorouracilo | [224][225][226] | Uracilo analógico | D (Au) | IV | Timidilato sintasa inhibidor. | Anal, Mama, colorrectal, gástrico, cabeza y cuello, esofágica y pancreático cáncer. Enfermedad de Bowen y queratosis actínica. | Mielosupresión, diarrea, cardiotoxicidad, GI ulceración y sangrado (poco común), encefalopatía (poco común), síndrome cerebeloso (poco común) y anafilaxia (rara vez). |
| Gemcitabina | [227][228][229] [230][231][232] [233] |
Desoxicitidina analógico | D (Au) | IV | Inhibidor de la síntesis de ADN, induce apoptosis específicamente en fase S. | Vejiga, Mama, nasofaríngeo, pulmón de células no pequeñas, ovárico y cáncer pancreático, linfomas y enfermedad inflamatoria intestinal. | Mielosupresión, toxicidad pulmonar, insuficiencia renal (raro), síndrome urémico hemolítico(raro), púrpura trombocitopénica trombótica reacción anafilactoide (raro), (rara), síndrome leucoencephalopathy posterior reversible (raro), infarto de miocardio (rara vez) e insuficiencia cardíaca (raro). |
| Mercaptopurina | [234][235] | Hipoxantina analógico | D (Au) | PO | Inhibidor de la síntesis de purinas. | Leucemia linfoblástica aguda, leucemia promielocítica aguda, linfoma linfoblástico y enfermedad inflamatoria intestinal.[236] | Mielosupresión, hepatotoxicidad, ulceración GI (rara), pancreatitis (rara) y leucemia secundaria (rara) o mielodisplasia (raro). |
| Nelarabina[237] | [238][239] [240][241][242] [243][244] |
Adenosina analógico | D (LOS E.E.U.U.) | IV | Inhibidor de la síntesis de purinas. | Leucemia linfoblástica aguda y leucemia linfocítica crónica. | Mielosupresión, derrame pleural, convulsiones, síndrome de lisis tumoral y una condición similar a Síndrome de Guillain-Barré. |
| Pentostatina | [245][246][247] [248][249][250] |
Adenosina analógico | D (LOS E.E.U.U.) | IV | Desaminasa de la adenosina inhibidor. | Leucemia de células pilosas, linfoma de células T periférico (huérfano), linfoma cutáneo de células T (huérfana) y leucemia linfocítica crónica (huérfano). | Mielosupresión, anemia hemolítica púrpura y microangiopática trombocitopénica trombótica, hiponatremia, neurotoxicidad, hipersensibilidad inmune. |
| Tegafur | [251][252][253] [254][255][256] [257] |
Fluorouracilanalogue | D (Au) | PO | Timidilato inhibidor de la sintetasa. | Mama, cáncer colorrectal, la vesícula biliar, tracto gastrointestinal, cabeza y cuello, hígado y cáncer de páncreas. | Mielosupresión, diarrea, neurotoxicidad y hepatitis (rara). |
| Tioguanine | [258][259][260] [261][262] |
Guanina analógico. | D (Au) | PO | Inhibidor de la síntesis de purinas. | Leucemia linfoblástica aguda y leucemia mieloide aguda | Mielosupresión, hepatotoxicidad, neuropatía periférica (poco común), necrosis intestinal (rara) y perforación (rara). |
| 1.02 antifolates | |||||||
| Metotrexato | [263][264][265] [266][267][268] |
Análogo del ácido fólico | D (Au) | SC, IM, IV, PO | Dihidrofolato reductasa inhibidor. | Vejiga y Mama cáncer. carcinoma de células escamosas de cabeza y cuello, enfermedad trofoblástica gestacional, leucemias agudas, linfoma no Hodgkin, osteosarcoma, tumores del cerebro injerto - versus - host disease y esclerosis sistémica. | Mielosupresión, toxicidad pulmonar, neurotoxicidad (administración intratecal o dosis alta), hepatotoxicidad, reacciones anafilácticas (raras), síndrome de Stevens – Johnson (raro), necrólisis epidérmica tóxica (raro), insuficiencia renal (rara), osteoporosis (rara), necrosis de piel y huesos (rara) y anemia macrocítica (rara vez). |
| Pemetrexed | [269][270][271] [272][273][274] [275][276] [277][278][279] [280][280][281] [282][283][284] [285][286][287] [288][289][290] [291][292][293] |
Análogo del ácido fólico | D (Au) | IV | Dihidrofolato reductasa, timidilato sintasa y glycinamide ribonucleotide formyltransferase inhibidores. | Mesotelioma maligno y cáncer de pulmón de células no pequeñas no escamosa. | Mielosupresión, insuficiencia renal, neuropatía periférica, Taquicardia supraventricular (poco común), hepatitis (raro), colitis (raro), neumonitis (raro), radiación recall (raro), – Johnson síndrome de Stevens (raro) y necrólisis epidérmica tóxica (rara). |
| Raltitrexed | [294][295][296] [296][297][298] [299][300] |
Quinazolinona | D (Au) | IV | Dihidrofolato reductasa y timidilato sintasa inhibidor. | Cáncer colorrectal | Mielosupresión |
| 1.03 otros antimetabolitos | |||||||
| Hidroxicarbamida | [301][302][303] [70°][305][306] [307][308][309] [310] |
Urea analógico | D (Au) | PO | Inhibe la síntesis de ADN inhibiendo la enzima reductasa ribonucleótido. | Leucemia mieloide crónica, Trombocitosis esencial, Policitemia vera, Mielofibrosis, leucemia mieloide aguda y anemia de células falciformes | Mielosupresión, piel cáncer (raro), edema (raro), alucinaciones (raro), convulsiones (raras) y toxicidad pulmonar (poco común). |
| 1.04 Topoisomerasa I inhibidor | |||||||
| Irinotecan | Camptotecina | D (Au) | IV | Inhibe Topoisomerasa I. | Cáncer colorrectal | Diarrea, mielosupresión, infiltrados pulmonares (poco común), bradicardia (poco común), íleo (raro) y colitis (rara). | |
| Topotecán | Camptotecina | D (Au) | IV | Inhibe Topoisomerasa I. | Cáncer de pulmón de células pequeñas, cáncer de ovario y cáncer de cuello uterino | Diarrea, mielosupresión, enfermedad pulmonar intersticial y alergia. | |
| 1.05 las antraciclinas | |||||||
| Daunorrubicina | Antraciclina | D (Au) | IV | Inhibe la síntesis de DNA y RNA por intercalando pares de bases del ADN. Inhibe la reparación del ADN inhibiendo Topoisomerasa II. | Leucemias agudas | Mielosupresión, cardiotoxicidad, Anafilaxia (rara), malignidades secundarias (particularmente leucemia mieloide aguda y síndrome mielodisplásico) y radiación. | |
| Doxorrubicina | Antraciclina | D (Au) | IV | Como anteriormente. | Mama cáncer, linfomas, sarcomas, cáncer de vejiga, leucemia linfoblástica aguda, Tumor Wilms'Relacionadas con el SIDA Sarcoma de Kaposi, neuroblastoma y mieloma múltiple | Como anteriormente. | |
| Epirubicina | Antraciclina | D (Au) | IV | Como anteriormente. | El cáncer de mama, cáncer gástrico y cáncer de vejiga | Como anteriormente. | |
| Idarubicina | Antraciclina | D (Au) | IV, PO | Como anteriormente. | Leucemias agudas. | Como anteriormente. | |
| Mitoxantrona | Antracenediona | D (Au) | IV | Como anteriormente. | Linfoma no Hodgkin, leucemia mieloide aguda, cáncer de próstata y esclerosis múltiple | Como anteriormente. | |
| Valrubicina | Antraciclina | C (LOS E.E.U.U.) | IV | Como anteriormente. | Cáncer de vejiga. | Como anteriormente. | |
| 1.06 Podophyllotoxins | |||||||
| Etopósido | Podofilotoxina | D (Au) | IV, PO | Topoisomerasa II inhibidor. | Cáncer testicular, cáncer de ovario, cáncer de pulmón, la leucemia mieloide aguda, linfomas y sarcomas | Mielosupresión, reacciones de hipersensibilidad, Stevens – Johnson síndrome (raro), neuropatía periférica (poco común) y malignidades secundarias (especialmente leucemia mieloide aguda). | |
| Tenipósido | Podofilotoxina | D (Au) | IV | Topoisomerasa II inhibidor. | Linfomas, leucemia linfoblástica aguda y neuroblastoma | Como anteriormente. | |
| 1.07 Los taxanos | |||||||
| Cabazitaxel | Taxano | D (Au) | IV | Inhibidor de desmontaje de microtúbulos. Arresta a las células en fase M y fase G2 tardía. | Cáncer de próstata | Mielosupresión, diarrea, insuficiencia renal, hipersensibilidad, reacciones severas GI (incluyendo la perforación, íleo, colitis, etc.; todo raro) y neuropatía periférica | |
| Docetaxel | Taxano | D (Au) | IV | Como anteriormente. | El cáncer de mama, cáncer de pulmón de células no pequeñas, cáncer de ovario, cáncer de próstata, cáncer de células escamosas de cabeza y cuello y cáncer gástrico. | Mielosupresión, neuropatía periférica, hipersensibilidad, retención de líquidos, insuficiencia cardiaca (poco común), la toxicidad pulmonar (rara), memoria de radiación (raro), (raro), cambios en la piel escleroderma-como Stevens – Johnson síndrome (raro), necrólisis epidérmica tóxica (rara), convulsiones (raras) y encefalopatía (rara) | |
| Paclitaxel | Taxano | D (Au) | IV | Como anteriormente. | El cáncer de ovario, cáncer de mama, cáncer de pulmón no microcítico, el sarcoma de Kaposi relacionado con SIDA, cáncer de cuello uterino, cáncer de células germinales y cáncer de endometrio | Hipersensibilidad, mielosupresión, neuropatía periférica, infarto de miocardio (poco común), arritmias (poco común), la toxicidad pulmonar (rara), memoria de radiación (raro), (raro), cambios en la piel escleroderma-como Stevens – Johnson síndrome (raro), necrólisis epidérmica tóxica (rara), convulsiones (raras) y encefalopatía (rara). | |
| 1.08 alcaloides de la Vinca | |||||||
| Vinblastina | Alcaloide de la Vinca | D (Au) | IV | Inhibidor de la Asamblea de microtúbulos. Las detenciones las células en fase M. | Linfoma de Hodgkin, tumores de células germinales, cáncer de pulmón de células no pequeñas, cáncer de vejiga y trombocitopenia inmune primaria | Neurotoxicidad, mielosupresión, isquemia del miocardio (rara) e infarto de miocardio (raro). | |
| Vincristina | Alcaloide de la Vinca | D (Au) | IV | Como anteriormente. | Linfomas, leucemia linfoblástica aguda, mieloma múltiple, sarcoma, tumores cerebrales, tumor de Wilms, neuroblastoma y trombocitopenia inmune primaria | Neurotoxicidad, Anafilaxia (rara), isquemia del miocardio (rara) e infarto de miocardio (raro). | |
| Vindesine | Alcaloide Vinka | D (Au) | IV | Como anteriormente. | Melanoma metastático refractario, leucemia linfoblástica aguda infantil, leucemia mieloide crónica en Crisis blásticas, neuroblastoma, cáncer de pulmón no microcítico y el cáncer de mama. | Íleo mielosupresión, neurotoxicidad y paralítica. | |
| Vinflunina | Alcaloide de la Vinca | D (Au) | IV | Como anteriormente. | Cáncer de vejiga | Según la vinblastina. | |
| Vinorelbina | Alcaloide de la Vinca | D (Au) | IV | Como anteriormente. | El cáncer de mama y cáncer de pulmón de células no pequeñas. | Como anteriormente. | |
| 1.09 agentes alquilantes | |||||||
| Bendamustina | Mostaza nitrogenada | D (Au) | IV | Alkylates ADN. | Leucemia linfocítica crónica, linfoma de la célula y el linfoma de Hodgkin. | Mielosupresión, hipocaliemia y taquicardia. | |
| Busulfan | Dialkylsulfonate | D (Au) | IV, PO | Alkylates ADN. | Tratamiento antes de acondicionamiento células madre hematopoyéticas (alta dosis, IV), leucemia mieloide crónica, Mielofibrosis, Policitemia vera y Trombocitosis esencial | Mielosupresión, convulsiones (dosis alta), taquicardia (dosis alta), síndrome de obstrucción sinusoidal hepática (dosis alta), Addison-como síndrome (raro), fibrosis pulmonar (rara), cataratas (raras) y hepatitis (rara). Malignidades secundarias.[156][311] | |
| Carmustina | Nitrosourea | D (Au) | IV | Alkylates ADN. | Astrocitoma anaplásico, glioblastoma multiforme y Micosis fungoide (tópico) | Mielosupresión, fibrosis pulmonar, infiltrados pulmonares, convulsiones, edema cerebral, fugas del líquido cefalorraquídeo, colección flúida subdural, infección intracraneal, hipotensión (poco común), taquicardia (poco común), disminución en el tamaño del riñón (reversible), uremia (poco común), insuficiencia renal (poco común), toxicidad hepática severa (rara), trombosis (raro) y neuroretinitis (raro). Malignidades secundarias.[156][311] | |
| Clorambucilo | Mostaza nitrogenada | D (Au) | IV | Alkylates ADN. | Linfoma, leucemia linfocítica crónica y Macroglobulinemia de Waldenström | Mielosupresión, alucinaciones (raras), convulsiones (raras), cistitis estéril (rara), hepatotoxicidad (rara), neumonitis severa (raro), Stevens – Johnson síndrome (raro), necrólisis epidérmica tóxica (rara) y la fiebre drogas (rara). Malignidades secundarias.[156][311] | |
| Chlormethine | Mostaza nitrogenada | D (Au) | IV, tópico | Alkylates ADN. | Linfoma cutáneo de células T, carcinoma metastásico, leucemias, linfomas, policitemia vera y broncogénico carcinoma | Trombosis, mielosupresión (común), hiperuricemia, eritema multiforme, anemia hemolítica, náuseas y vómitos (severo) y malignidades secundarias.[311] | |
| Ciclofosfamida | Mostaza nitrogenada | D (Au) | IV | Alkylates ADN. | El cáncer de mama, linfoma, leucemia linfoblástica aguda, leucemia linfocítica crónica, sarcoma mieloma múltiple, Macroglobulinemia de Waldenström, lupus eritematoso sistémico, Glomerulonefritis, vasculitis sistémica y Granulomatosis de Wegener | Mielosupresión, náusea y vómito (> 30%), cistitis hemorrágica, insuficiencia cardíaca (raro), fibrosis pulmonar (rara), síndrome de obstrucción sinusoidal hepática (raro), retención de agua que se asemejaban a SIADH (raro) y convulsiones (raras). Malignidades secundarias.[311] | |
| Dacarbacina | Triazene | D (Au) | IV | Alkylates ADN. | Linfoma de Hodgkin, melanoma maligno metastásico y sarcoma de tejidos blandos | Mielosupresión, agranulocitosis (poco común), trombosis de la vena hepática (raro) y necrosis hepatocelular (rara). Malignidades secundarias.[311] | |
| Fotemustina | Nitrosourea | D (Au) | IV | Alkylates ADN. | Melanoma maligno metastásico. | Mielosupresión. | |
| Ifosfamida | Mostaza nitrogenada | D (Au) | IV | Alkylates ADN. | Los sarcomas, cáncer testicular y linfomas. | Mielosupresión, cistitis hemorrágica, nefrotoxicidad, neurotoxicidad y cardiaco toxicidad (rara). Malignidades secundarias.[311] | |
| Lomustina | Nitrosourea | D (Au) | PO | Alkylates ADN. | Glioma y meduloblastoma. | Mielosupresión, infiltración pulmonar y fibrosis. Malignidades secundarias.[311] | |
| Melfalán | Mostaza nitrogenada | D (Au) | IV, PO | Alkylates ADN. | Melanoma maligno de las extremidades, mieloma múltiple, tratamiento antes de acondicionamiento trasplante de células madre hemopoyéticas. | Mielosupresión, fibrosis pulmonar y neumonitis (poco común), la piel necrosis (poco común), anafilaxia, síndrome de obstrucción sinusoidal hepática y SIADH. Malignidades secundarias.[311] | |
| Streptozotocin | Nitrosourea | D (Au) | IV, PO | Alkylates ADN. | Cáncer pancreático y síndrome carcinoide. | Nefrotoxicidad, hipoglucemia, mielosupresión, náusea y vómito (> 90%), ictericia y diabetes insípida nefrogénica (rara). | |
| Temozolomida | Triazene | D (LOS E.E.U.U.) | PO | Alkylates ADN. | Astrocitoma anaplásico, glioblastoma multiforme, el melanoma maligno metastásico | Mielosupresión, Stevens – Johnson síndrome (raro), neumonitis (rara) y hepatitis (rara). | |
| 1.10 compuestos de platino de | |||||||
| Carboplatino | Complejos de platino | D (Au) | IV | Reacciona con el ADN, induciendo apoptosis, ciclo de la célula específica. | Cáncer de ovario, cáncer de pulmón y cáncer de células escamosas de cabeza y cuello | Mielosupresión, náusea y vómito (30-90%), neuropatía periférica, ototoxicidad, anafilaxia, insuficiencia renal aguda (rara), síndrome urémico hemolítico (raro) y pérdida de la visión (poco común). | |
| Cisplatino | Complejos de platino | D (Au) | IV | Como anteriormente. | Tumores de células germinales (incluyendo cáncer testicular), cáncer de ovario, cáncer de cuello uterino, células pequeñas y no pequeñas células de cáncer de pulmón, mesotelioma, cáncer de células escamosas de cabeza y cuello, cáncer de esófago, cáncer gástrico, cáncer de vejiga y osteosarcoma | Nefrotoxicidad, náuseas y vómito (30-100%), mielosupresión, anomalías del electrólito, neuropatía periférica, ototoxicidad y anafilaxia, anemia hemolítica (raro), neuritis óptica (rara), síndrome leucoencephalopathy posterior reversible (raro), convulsiones (raras), cambios en el ECG (raro) e insuficiencia cardiaca (raro). | |
| Nedaplatin | [312] | Complejos de platino | N / A | IV | Como anteriormente. | Cáncer de pulmón de células no pequeñas, cáncer de esófago, cáncer cervical uterino, cáncer de cabeza y cuello y cáncer urotelial | Nefrotoxicidad, mielosupresión y náuseas y vómitos (30-90%). |
| Oxaliplatino | Complejos de platino | D (Au) | IV | Como anteriormente. | El cáncer colorrectal, cáncer de esófago y cáncer gástrico | Mielosupresión, neuropatía periférica, anafilaxia, náuseas y vómitos (30-90%), hipocaliemia, acidosis metabólica, la enfermedad pulmonar intersticial (poco común), ototoxicidad (raro), síndrome leucoencephalopathy posterior reversible (raro), inmune-mediada cytopenias (raro) y síndrome de obstrucción sinusoidal hepático (poco común). | |
| 1.11 varios otros | |||||||
| Altretamina | Triazina | D (Au) | PO | Claros, reactivos intermedios covalentemente enlazar a microsomales proteínas y ADN, posiblemente causando daños en el ADN | Cáncer de ovario recidivante | Mielosupresión, neuropatía periférica, convulsiones y hepatotoxicidad (rara). | |
| Bleomicina | Glucopéptido | D (Au) | IP, IV o IM, SC, IA | Inhibe la DNA y en menor medida síntesis de ARN, produce filamento solo y doble rupturas en el ADN posiblemente por la formación de radicales libres. | Tumores de células germinales, carcinoma de células escamosas, cáncer pancreático, non-Hodgkin, esclerótica pleural y el linfoma de Hodgkin. | Toxicidad pulmonar, hipersensibilidad, esclerodermia y El fenómeno de Raynaud. | |
| Bortezomib | Ácido borónico dipeptidil | C (Au) | IV, SC | Proteasoma inhibidor. | Mieloma múltiple, linfoma de la célula y linfoma folicular (huérfano). | Neuropatía periférica, neutropenia, trombocitopenia, anemia, hipotensión ortostática, hepatitis (raro/raro), hemorragia (raro/raro), insuficiencia cardíaca (raro/raro), convulsiones (raro/raro), leucoencephalopathy multifocal progresiva (PML) y pérdida de la audición. | |
| Dactinomicina | Polipéptido | D (Au) | IV | Complejos con ADN interfiriendo con la síntesis de ARN ADN-dependiente | Rabdomiosarcoma, tumor de Wilms y enfermedad trofoblástica gestacional | Mielosupresión, anafilaxis, llamada radiación, hepatotoxicidad y síndrome de obstrucción sinusoidal hepática (común en tumor de Wilms). | |
| Estramustina | Analógico de mostaza y estrógenos de nitrógeno | D (Au) | PO | Acciones estrogénicas y antimitótica | Cáncer de próstata. | Las complicaciones cardiovasculares, tales como cardiopatía isquémica, tromboembolismo venoso, insuficiencia cardíaca congestiva, embolismo pulmonar, infarto de miocardio e insuficiencia cerebrovascular. | |
| Ixabepilona | Epothilone B analógico | D (LOS E.E.U.U.) | IV | Promueve la polimerización de la tubulina y estabiliza la función microtubular, provocando la detención del ciclo celular en la fase G2/M y posteriormente induce apoptosis | Cáncer de mama localmente avanzado o metastásico. | Mielosupresión, neuropatía periférica, isquemia del miocardio (raro/raro), arritmia supraventricular (raro/raro) y reacción de hipersensibilidad (raro/raro). | |
| Mitomicina | Aziridine | D (Au) | IV | ADN de enlaces cruzados | Cáncer anal y de la vejiga | Mielosupresión, toxicidad pulmonar y síndrome urémico hemolítico (raro). | |
| Procarbazina | Methylhydrazine | D (Au) | IM, IV | Inhibe la síntesis de DNA, RNA y proteínas. | Glioma y el linfoma de Hodgkin. | Mielosupresión, neurotoxicidad, fibrosis pulmonar (raro/raro), neumonitis (raro/raro), hemolisis (raro/raro) y disfunción hepática (raro/raro). | |
| 2. objetivo antineoplásicos | |||||||
| 2.1 los anticuerpos monoclonales | |||||||
| Alemtuzumab | Proteína | B2 (Au) | IV | CD52 anticuerpo induce apoptosis en las células del etiquetado. | Leucemia linfocítica crónica | Pancitopenia, neumonitis, arritmias y reacciones de hipersensibilidad (raras), anemia hemolítica autoinmune (rara), trombocitopenia autoinmune (rara) y leucoencephalopathy multifocal progresiva (rara vez). | |
| Bevacizumab | Proteína | D (Au) | IV | VEGF inhibidor. | Cáncer colorrectal, mama, ovario, renal de la célula y no escamosa no-pequeño célula de cáncer de pulmón y glioblastoma | Hipertensión arterial, tromboembolismo, insuficiencia cardíaca, sangrado, neutropenia, trombocitopenia, GI perforación, formación de fístulas, encefalopatía hipertensiva, hipertensión pulmonar, síndrome leucoencephalopathy posterior reversible, perforación del tabique nasal y osteonecrosis de la mandíbula. | |
| Cetuximab | Proteína | D (Au) | IV | EGFR inhibidor. | Cáncer de células escamosas de cabeza y cuello o EGFR positivos y KRAS salvaje-tipo cáncer colorrectal metastásico. | Reacciones infusión-relacionadas, reacciones cutáneas, hipomagnesemia, hipocalcemia, hipocaliemia, coágulos de sangre, enfermedad pulmonar intersticial y meningitis aséptica. | |
| Denosumab | Proteína | X (US) | SC | RANKL inhibidor. | La osteoporosis, incluyendo drogas y cáncer relacionados con la osteoporosis, tumor de células gigantes del hueso y el hypercalcaemia de malignidades | Hipercolesterolemia, catarata, retención urinaria, hipocalcemia, osteonecrosis de la mandíbula y la anafilaxia. | |
| Gemtuzumab ozogamicina | [313] | Proteína | D (LOS E.E.U.U.) | IV | CD33 anticuerpo que induce la apoptosis de la célula de etiquetado. | Leucemia mieloide aguda | Enfermedad veno-oclusiva hepática, mielosupresión, síndrome de liberación de citoquinas, hipersensibilidad y anomalías del electrólito. |
| Ibritumomab tiuxetan | [314][315] | Proteína | D (LOS E.E.U.U.) | IV | CD20 anticuerpo enlazado con el isótopo radiactivo, 808, induce la lisis celular dependiente de la radiación. | Linfoma no Hodgkin y el linfoma folicular. | Trombocitopenia, neutropenia, anemia, hipotensión y malignidades secundarias. |
| Ipilimumab | Proteína | C (Au) | IV | CTLA4 anticuerpo que causa la lisis mediada por el sistema inmune de la celda etiquetada | Melanoma maligno inoperable o metastático. | Peligrosa para la vida inmune mediada por fiebre y reacciones. | |
| Ofatumumab | [316][317][318] | Proteína | C (LOS E.E.U.U.) | IV | Anti-CD20 anticuerpo. | Leucemia linfocítica crónica | Neutropenia, neumonía, reacciones de infusión, cytopenias |
| Panitumumab | Proteína | C (Au) | IV | Inhibidor de EGFR. | Cáncer colorrectal metastásico RAS (KRAS o ANR) tipo salvaje | Las reacciones cutáneas, las anomalías del electrólito, anafilaxia y angiooedema (raro). | |
| Pertuzumab | Proteína | D (Au) | IV | HER2 inhibidor. | Cáncer de mama positivo para HER2. | Anafilaxia, disfunción cardiaca y la anemia. | |
| Rituximab | Proteína | C (Au) | IV | Anti-CD20 anticuerpo. | Célula de B CD20-positive linfoma no Hodgkin, leucemia linfocítica crónica, artritis reumatoide, Granulomatosis de Wegener y polyangiitis microscópico | Reacciones infusión-relacionadas, neutropenia, arritmias, infección, trombocitopenia (poco común), anemia (poco común), angina de pecho (poco común), infarto de miocardio (poco común), insuficiencia cardíaca (poco común), anemia hemolítica (rara), anemia aplástica (rara), enfermedad del suero (rara), condiciones severas de la piel (raros), infiltrados pulmonares (raros), neumonitis (rara), neuropatía craneal (visión o hipoacusia; raro) y leucoencephalopathy multifocal progresiva (raro). | |
| Tositumomab | [319][320] | Proteína | X (US) | IV | Anti-CD20 anticuerpo que está etiquetado con I131. | Linfoma no-Hodgkin | Grado 3-4 cytopenias, metahemoglobinemia, leucemia mieloide aguda o síndrome mielodisplásico, anafilaxia y hipertiroidismo. |
| Trastuzumab | Proteína | B2 (Au) | IV | Anti-HER2 anticuerpo. | El cáncer de mama positivo para HER2, cáncer gástrico, cáncer pancreático (huérfana) y cáncer de la Unión gastroesofágica. | La disfunción cardiaca, reacciones infusión-relacionadas, neuropatía periférica y la toxicidad pulmonar (poco común). | |
| 2.2 inhibidor de la cinasa de tirosina | |||||||
| Afatinib | [321] | Fenil quinazolinamine | D (LOS E.E.U.U.) | PO | EGFR, HER2 y HER4 inhibidor. | Cáncer de pulmón de células no pequeñas. | Diarrea, hipocaliemia, enfermedad pulmonar intersticial y hepatotoxicidad. |
| Aflibercept | [322] | Proteína | C (LOS E.E.U.U.) | IV | VEGF y PGF inhibidor. | Cáncer colorrectal. | Mielosupresión, hipertensión, deshidratación, coágulos sanguíneos, GI perforación y reversible leucoencephalopathy posterior síndrome (poco común). |
| Axitinib | [323] | Indazole & piridina analógico | D (Au) | PO | Inhibidor de multicinasas. | Carcinoma de células renales | Hipertensión, disfunción de la tiroides, coágulos de sangre, trastornos electrolíticos, GI perforación (rara), formación de la fístula (rara), síndrome leucoencephalopathy posterior reversible (raro) y Policitemia (poco común). |
| Bosutinib | [324][325] | Analógico carbonitrilo quinoleina | D (Au) | PO | Bcr-Abl y el inhibidor de la cinasa SRc. | Leucemia mieloide crónica | Diarrea, trombocitopenia, neutropenia, hepatotoxicidad, prolongación del intervalo QT, insuficiencia renal, derrame pleural, pericarditis (raro/raro), pancreatitis aguda (raro/raro), hemorragia GI (raro/raro), shock anafiláctico (raro/raro), edema pulmonar agudo (raro/raro), insuficiencia respiratoria (raro/raro), hipertensión pulmonar(raro/raro) y eritema multiforme (raro/raro). |
| Crizotinib | [326][327][328] [329][330] |
Aminopiridina | D (LOS E.E.U.U.) | PO | ALK, Receptor de Factor de crecimiento del hepatocito (HGFR, c-Met) e inhibidor de Recepteur d ' origine Nantais (RON). | Cáncer de pulmón de células no pequeñas | Linfopenia, neutropenia, hipofosfatemia, hipocaliemia, neuropatía periférica, coágulos sanguíneos, prolongación del intervalo QT, bradicardia, neumonía, neumonitis, quiste renal, ARDS e insuficiencia hepática. |
| Dasatinib | Piperazina | D (Au) | PO | BCR-ABL, familia SRC, c-Kit, EPHA2 y PDGFRInhibidor de la cinasa - β. | Philadelphia positivo leucemia mieloide crónica y leucemia linfoblástica aguda. | Retención de líquidos, mielosupresión, hemorragia, hipertensión, anomalías electrolíticas, disfunción cardiaca (rara), insuficiencia cardíaca (raro), infarto de miocardio, arritmia (rara), prolonga el intervalo QT (raro), insuficiencia renal (raro), hipersensibilidad (raro) y fallo hepático (poco común). | |
| Erlotinib | Quinazolina | C (Au) | PO | EGFR inhibidor. | Cáncer de pulmón de células no pequeñas y cáncer de páncreas. | Piel reacciones, diarrea, Sangrado GI, anemia, deshidratación, enfermedad pulmonar intersticial (poco común), insuficiencia hepática (raro), hepatorrenal síndrome (raro), GI perforación (rara) y queratitis ulcerosa (rara). | |
| Gefitinib | Quinazolina | C (Au) | PO | EGFR inhibidor. | EGFR-cáncer de pulmón no pequeñas positivo mutación. | Piel reacciones, diarrea, deshidratación, hemorragia, enfermedad pulmonar intersticial (poco común), pancreatitis (poco común), hepatitis (poco común), alergia (poco común), insuficiencia hepática (raro), necrólisis epidérmica tóxica (raro) y Síndrome de Stevens – Johnson (rara vez). | |
| Imatinib | Pirimidina y piperazina. | D (Au) | PO | Inhibidor de la quinasa Bcr-Abl. | Leucemia linfoblástica aguda cromosoma-positiva de Philadelphia, la leucemia mieloide crónica, tumor estromal GI y mielodisplásicos/mieloproliferativos. | Mielosupresión, retención de líquidos, Sangrado GI, anomalías electrolíticas, disfunción ventricular izquierda (poco común), insuficiencia cardíaca (poco común), edema pulmonar (poco común), insuficiencia renal (poco común), angiooedema (rara), anafilaxis (raro), GI perforación (rara), hepatotoxicidad (rara), Miopatía (raro), necrosis avascular (raro) y rabdomiólisis (rara vez). | |
| Lapatinib | Quinazolina | C (Au) | PO | HER2 inhibidor. | HER2-cáncer de mama positivo, cáncer (huérfana) y cáncer de esófago (huérfano) del estómago. | Diarrea, enfermedad pulmonar intersticial (poco común), hepatotoxicidad (poco común) y anafilaxia (rara). | |
| Nilotinib | Imidazol | D (Au) | PO | Inhibidor de la quinasa Bcr-Abl. | Leucemia mieloide crónica. | Mielosupresión, disturbios del electrólito, hiperglucemia, intervalo QT prolongado (poco común), enfermedad arterial periférica oclusiva (poco común), pancreatitis (poco común), derrame pleural (poco común) y derrame pericárdico (poco común). | |
| Pazopanib | Indazole | D (Au) | PO | Inhibidor de multicinasas, incluyendo c-KIT, FGFR, PDGFR y VEGFR. | Carcinoma de células renales y sarcoma de tejidos blandos. | Hipertensión, prolongación del intervalo QT, hemorragia, coágulos de sangre, neutropenia, trombocitopenia, neutropenia, trombocitopenia, tirotropina elevada, hipotiroidismo, alteraciones electrolíticas, hipo o hiperglicemia, pointes de torsades de (poco común), insuficiencia cardíaca (poco común), fallo hepático (poco común), perforación de GI (poco común), formación de fístulas (poco común) y síndrome leucoencephalopathy posterior reversible (raro). | |
| Ponatinib | [331][332] | Imidazopyridazine | D (LOS E.E.U.U.) | PO | Inhibidor de multicinasas (BEGFR, PDGFR, FGFR, EPH receptores y familias SRC de quinasas y KIT, RET, TIE2 y FLT3), que también inhibe la quinasa Bcr-Abl T135I. | La leucemia mieloide crónica positiva T135I y leucemia linfoblástica aguda positiva de la cromosoma de Philadelphia. | Hipertensión, neutropenia, leucopenia, anemia, trombocitopenia, linfopenia, derrame pleural, insuficiencia cardiaca, neuropatía periférica, hemorragia, coágulos de sangre, pancreatitis e infección. |
| Regorafenib | [333][73°][335] [336] |
4-phenoxypyridine | D (LOS E.E.U.U.) | PO | Multicinasas inhibidor para RET VEGFR1, VEGFR2, VEGFR3, KIT, PDGFR-alfa, PDGFR-beta, FGFR1, FGFR2, TIE2, DDR2, Trk2A, Eph2A, RAF-1, BRAF, BRAFV600E, SAPK2, PTK5 y Bcr-Abl. | El cáncer colorrectal y tumores estromales GI. | Anemia, linfopenia, trombocitopenia, anomalías del electrólito, hepatotoxicidad, hipertensión, hipotiroidismo, neutropenia, isquemia miocárdica o infarto. |
| Ruxolitinib | [337][338][339] [340] |
Pyrimidinylpyrazole | C (Au) | PO | JAK1 y JAK2 inhibidor. | Mielofibrosis y el cáncer de páncreas (huérfano). | Anemia y trombocitopenia. |
| Sorafenib | 4-phenoxypyridine | D (Au) | PO | Multicinasas inhibidor (incluyendo las quinasas receptor VEGF y PDGF). | Carcinoma de células renales y carcinoma hepatocelular. | Hipertensión, reacciones de la piel, sangrado, neutropenia, trombocitopenia, linfopenia, neuropatía periférica, disfunción de la tiroides, anomalías del electrólito, miocardio isquemia o infartos, insuficiencia cardíaca (poco común), GI perforación (poco común), pancreatitis (poco común), leucoencephalopathy posterior reversible síndrome (raro), hepatitis (rara), síndrome nefrótico (raro) y el intervalo QT prolongado (raro). | |
| Sunitinib | Oxindole | D (Au) | PO | Inhibidores multicinasas (incluyendo VEGF y PDGF receptor tirosina quinasas) | carcinoma de células renales, tumor estromal GI y tumor neuroendocrino pancreático | Neutropenia, trombocitopenia, linfopenia, hipertensión, dejado la disfunción ventricular, insuficiencia cardiaca, coágulos de sangre, disfunción de la tiroides, anomalías del electrólito, pancreatitis (poco común), fallo hepático (poco común), prolongan el intervalo QT (raro), pointes de torsades de (raros), GI perforación (rara), formación de la fístula (rara), convulsiones (raras), síndrome leucoencephalopathy posterior reversible (raro), síndrome urémico hemolítico (raro), púrpura trombocitopénica trombótica (rara), síndrome nefrótico (raro), hipersensibilidad (rara), angiooedema (raro), necrólisis epidérmica tóxica (rara) y Stevens síndrome - Johnson (raro). | |
| Vandetanib[341] | Quinazolina | D (LOS E.E.U.U.) | PO | Inhibidor de la cinasa de la tirosina (TKI) con actividad selectiva contra RET, VEGFR-2 y EGFR | Cáncer medular de tiroides. | Diarrea, hipertensión, prolongación del intervalo QT, depresión, anomalías del electrólito, hipotiroidismo y perforación GI (poco común). | |
| 2.3 mTOR inhibidores de la | |||||||
| Everolimus | Sirolimus analógico. | C (Au) | PO | inhibidor de mTOR. | Cáncer de células renales, tumor neuroendocrino pancreático y el cáncer de mama | Efusión pleural, hiperglucemia, hipercolesterolemia, hipertrigliceridemia, neutropenia, linfopenia, trombocitopenia, anemia, hemorragia, insuficiencia renal, hipocaliemia, hipofosfatemia, neumonitis, alteración de la cicatrización de heridas (poco común), Anafilaxia (rara) y angiooedema (raro). | |
| Temsirolimus | Sirolimus analógico. | D (Au) | IV | inhibidor de mTOR. | Células renales cáncer y manto linfoma. | Reacciones de infusión, problemas de cicatrización, hiperglucemia, hipercolesterolemia, hipertrigliceridemia, neutropenia, linfopenia, trombocitopenia, anemia, hemorragia, insuficiencia renal, hipocaliemia, hipofosfatemia, neumonitis, perforación del intestino (poco común) y hemorragia intracerebral y Stevens – Johnson síndrome (raro). | |
| 2.4 retinoides | |||||||
| Este medicamento | 9-cis retinoico | D (LOS E.E.U.U.) | Tópico | Receptor de ácido retinoico (RAR) y receptor X retinoide Agonista (RXR). | Sarcoma de Kaposi. | Edema, erupciones | |
| Bexaroteno[342] | Phenethylnaphthalene | X (US) | PO, tópico | Agonistas RXR. | Linfoma de células T cutáneo | Leucopenia, anemia, deshidrogenasa láctica aumentada, anemia hipocrómica, hiperlipidemia, hipercolesterolemia, hipotiroidismo, hemorragia, hipertensión y riñón disfunción. | |
| Isotretinoína | ácido 13-cis retinoico | D (Au, tópica), X (Au, oral) | PO, tópico | Agonistas RXR & RAR. | Neuroblastoma[343] y acné. | Tópico: Las reacciones cutáneas, las anomalías del lípido de la sangre, aumento de plaquetas y osteoporosis.[344] Oral: Anemia, velocidad de sedimentación de eritrocitos aumentado, trombocitopenia, trombocitosis, neutropenia, anafilaxia, hipersensibilidad, diabetes mellitus, hiperuricemia, disturbios psiquiátricos (raros), convulsiones (muy raras), conjuntivitis, vasculitis (muy rara), hemorragia GI (muy rara), hepatitis (muy rara), eritema multiforme, síndrome de stevens – Johnson, necrólisis epidérmica tóxica, artritis (muy rara), rabdomiólisis y Glomerulonefritis (muy raro).[345] | |
| Tamibarotene | [346][347][348] | Naftalina | N / A | PO | Agonista RAR. | Leucemia promielocítica aguda refractaria y la enfermedad de Alzheimer. | Hipercolesterolemia, hipertrigliceridemia, daño hepático, trastornos gastrointestinales, leucocitosis y síndrome de diferenciación. |
| Tretinoína | all-trans- ácido retinoico | D (Au, tópica), X (Au, oral) | PO, tópico | Agonistas RXR & RAR. | Acné y leucemia promielocítica aguda. | Oral: Síndrome de diferenciación, hyperleucocytosis, elevado colesterol y triglicéridos, arritmias, pancreatitis, elevadas las enzimas hepáticas, trombosis, hipertensión intracraneal y pseudotumor cerebri (principalmente en niños), ansiedad, depresión y ulceración genital (rara). Tópico: Eritema. | |
| 2.4 inmunomoduladores (IMiD) | |||||||
| Lenalidomida | Análogo de la talidomida | X (Au) | PO | Numerosas acciones; anti-angiogenesis (a través de la inhibición de la liberación VEGF), anti-TNF, IL-6 y pro-IL-2, IFN-Γ efectos. También estimula las células T y apoptosis en las células cancerosas. | Mieloma múltiple | Los coágulos de sangre, neutropenia (dosis limitantes), trombocitopenia (dosis limitantes), anemia, infección, hipotensión, hipocaliemia, hipotiroidismo, síndrome de Stevens – Johnson, necrólisis epidérmica tóxica, angioedema, neumonitis, hepatotoxicidad y malignidades secundarias (principalmente el síndrome mielodisplásico y la leucemia mieloide aguda). | |
| Pomalidomida | Análogo de la talidomida | X (US) | PO | Como anteriormente. | Mieloma múltiple y la esclerosis sistémica (huérfano). | Neutropenia, anemia, neumonía, trombocitopenia, hipercalcemia, hiperglucemia, insuficiencia renal, linfopenia, hiponatremia, hipocalcemia, hipocaliemia, neuropatía periférica y tromboembolismo. | |
| Talidomida | Talidomida | X (Au) | PO | Como anteriormente. | Mieloma múltiple, Eritema nodoso leproso y las siguientes indicaciones huérfanas: enfermedad injerto contra huésped, infección por micobacterias, úlceras aftosas recurrentes, la estomatitis aftosa recurrente severa, neoplasias cerebrales primarios, síndrome de emaciación asociada a VIH, enfermedad de Crohn, sarcoma de Kaposi, síndrome mielodisplásico y hematopoyéticas trasplante de la célula del tallo. | Neuropatía periférica, depresión, tromboembolismo, bradicardia, hipotensión ortostática, leucopenia, hipotiroidismo, trombocitopenia (poco común), síndrome de Stevens-Johnson (raro), necrólisis epidérmica tóxica (rara), neumonitis (rara), hepatotoxicidad (rara) y pérdida de la audición (poco común). | |
| 2.5 inhibidores de histona deacetilasa | |||||||
| Romidepsina | [349] | Depsipéptido | D (LOS E.E.U.U.) | IV | Histona deacetilasa inhibidor del, por lo tanto induce alteraciones en la expresión génica en las células afectadas. | Linfoma de células T periféricas y cutáneas. | Las anomalías del electrólito, anemia, trombocitopenia, neutropenia, linfopenia y anomalías del ECG. |
| Valproato[Nota 1] | [350][351][352] [353] |
Ramificada ácidos grasos de cadena corta. | D (Au) | PO, IV | Como anteriormente. | Profilaxis de la migraña, manía, epilepsia, síndrome X frágil(huérfano), poliposis adenomatosa familiar (huérfana) y los siguientes usos fuera de etiqueta: cáncer de cuello uterino, melanoma, mesotelioma, leucemia mieloide aguda y síndrome mielodisplásico. | Hyperammonaemia, trombocitopenia, ovarios poliquísticos, SIADH (poco común), insuficiencia hepática (raro), pancreatitis (rara), leucopenia (raro), neutropenia (rara), pura de eritrocitos agranulocitosis (rara), aplasia (rara), síndrome extrapiramidal (raro), redujo la DMO con el uso a largo plazo, derrame pleural (raro) y reacción de hipersensibilidad multiorgánica (rara). |
| Vorinostat | [354] | Phenyloctanediamide | D (LOS E.E.U.U.) | PO | Como anteriormente. | Según romidepsina. | Trombocitopenia, anemia, prolongación del intervalo QT y embolia pulmonar. |
| 2.6 otros agentes | |||||||
| Anagrelida | Imidazoquinazoline | B3 (Au) | PO | Fosfodiesterasa 3 inhibidor. | Trombocitopenia esencial | Retención de líquidos, palpitaciones, taquicardia, hepatotoxicidad (poco común), insuficiencia cardíaca (poco común), hipertensión (poco común), arritmia (poco común), síncope (poco común), cardiomiopatía (rara), cardiomegalia (rara), MI (raro), hipertensión pulmonar (rara), pancreatitis (rara) y enfermedad pulmonar intersticial (rara). | |
| Trióxido de arsénico[Nota 2] | Compuestos de arsénico | X (Au) | IV | No se entiende. Induce la diferenciación parcial y promueve la apoptosis de las células leucémicas y también puede inhibir la angiogénesis. | Leucemia promielocítica aguda refractaria o recidivante. Indicaciones huérfanas incluyen: leucemia mieloide aguda, leucemia linfocítica crónica, glioma maligno, síndrome mielodisplásico, mieloma múltiple, cáncer de hígado y leucemia mieloide crónica. | Síndrome de diferenciación, hyperleucocytosis, neutropenia, trombocitopenia, taquicardia ventricular, intervalo QT prolongado, pointes de torsades, bloqueo auriculoventricular completo, neuropatía periférica, hiperglucemia, hipocaliemia, hipomagnesemia, elevación de la bilirrubina o aminotransferasas, hepatotoxicidad y malignidades secundarias. | |
| Asparaginasa [Nota 3] |
Proteína | D (Au) | IM, IV | Cataliza la conversión del aminoácido L-asparragina a ácido aspártico y por lo tanto reduce la disponibilidad de L-Asparagina a las células leucémicas. A diferencia de las células normales, ciertos tipos de células leucémicas no sintetizan L-Asparagina, que es esencial para la supervivencia y crecimiento de la célula. | La leucemia linfoblástica aguda y linfoma linfoblástico. | Las reacciones alérgicas, eventos trombóticos y hemorrágicos, uremia, pancreatitis, hiperglucemia, hyperammonaemia, insuficiencia renal aguda insuficiencia y diabético cetoacidosis. | |
| BCG vacuna [Nota 4] |
Proteína | B2 (Au) | IB | Vivos, atenuados Mycobacterium bovis, que produce una reacción inflamatoria local, lo que resulta en la eliminación o reducción de las lesiones superficiales de tumor de la vejiga. | Cáncer de vejiga | Cistitis, infección de BCG y la vejiga contratada. | |
| La denileucina diftitox | [355][356][357] [358] |
Proteína | C (LOS E.E.U.U.) | IV | Interleucina-2 combinado con Toxina diftérica, que se une al receptor en las células inmunes interleuquina e introduce la toxina de la difteria en la célula. | Linfoma cutáneo de células T y linfoma de células T periféricas (huérfano). | Reacciones de infusión, hipocalcemia, hipotensión, trombocitopenia, insuficiencia renal aguda (raro/raro), Hyper, hipotiroidismo (raro/raro), pancreatitis (raro/raro) y necrólisis epidérmica tóxica (raro/raro). |
| Vemurafenib | Pyrrolopyridine | D (Au) | PO | BRAF inhibidor de la cinasa. | Melanoma metastásico de BRAF quinasa mutación V600E-positivo. | Las reacciones cutáneas, malignidades secundarias (principalmente de células escamosas), anafilaxis (raro) e hipotensión (rara). | |
| Abreviaturas/acrónimos: IM - Intramuscular. IV - intravenoso. IA - intrarterial. SC - subcutánea. PO - Per os, oral. IP - Intrapleural. IB - Intrabladder. Preg. gato. - Categoría de embarazo. La categoría de embarazo preferido es australiana, pero si es de carácter dada la categoría del embarazo es americana. |
|||||||
Notas
|
|||||||
Véase también
- Fármacos contra el cáncer (diario)
- Cáncer y náuseas
- Fatiga relacionada con el cáncer
- Quimio-cerebro
- Regímenes de quimioterapia
- Cytostasis
- Tratamientos experimentales contra el cáncer
- Manejo seguro de medicamentos peligrosos
- Terapia de hipertermia
- Inmunoterapia
- Red nacional integral del cáncer
- Deterioro cognitivo inducido por radiación
- Radioterapia
- Viroterapia
Referencias
- ^ Krumbhaar EB (1919). "Papel de la sangre y la médula ósea en ciertas formas de intoxicación por gas". JAMA 72:: 39 – 41. Doi:10.1001/Jama.1919.26110010018009f.
- ^ a b Gilman A (mayo de 1963). "El ensayo clínico inicial de mostaza de nitrógeno". Soy J. Surg. 105 (5): 574 – 8. Doi:10.1016/0002-9610 (63) 90232-0. PMID13947966.
- ^ Goodman LS, Wintrobe MM, Dameshek W, Goodman MJ, Gilman A, MT. McLennan (1946). "Terapia de mostaza de nitrógeno". JAMA 132 (3): 126-132. Doi:10.1001/Jama.1946.02870380008004.
- ^ Goodman LS Wintrobe MM, Dameshek W, Goodman MJ, Gilman A, McLennan MT (1984). "Artículo hito 21 de septiembre de 1946: terapia de la mostaza nitrogenada. Uso de metil-bis(beta-chloroethyl) clorhidrato de amina y tris(beta-chloroethyl) clorhidrato de Amina para la enfermedad de Hodgkin, Linfosarcoma, leucemia y ciertos trastornos afines y misceláneos. Por Louis S. Goodman, Maxwell M. Wintrobe, William Dameshek, Morton J. Goodman, Alfred Gilman y Margaret T. McLennan". JAMA 251 (17): 2255 – 61. Doi:10.1001/Jama.251.17.2255. PMID6368885.
- ^ Faguet, p. 71
- ^ Joensuu H (2008). "La quimioterapia sistémica para el cáncer: arma al tratamiento". The Lancet Oncology. 9 (3): 304. Doi:10.1016/S1470-2045 (08) 70075-5. PMID18308256.
- ^ a b DeVita VT, Chu E (noviembre de 2008). "Una historia de quimioterapia contra el cáncer". Cancer Res. 68 (21): 8643 soporte – 53. Doi:10.1158/0008-5472.CAN-07-6611. PMID18974103.
- ^ Nichols HJ, Walker JE (marzo de 1923). "Observaciones experimentales sobre la prophyaxis y el tratamiento de la sífilis". J exp Med. 37 (4): 525 – 42. Doi:10.1084/jem.37.4.525. PMC2128372. PMID19868743.
- ^ Hanahan d., Weinberg RA (enero de 2000) "Las características distintivas del cáncer". Celular 100 (1): 57 – 70. Doi:10.1016/S0092-8674 (00) 81683-9. PMID10647931.
- ^ Hodgson S (enero de 2008). "Mecanismos de susceptibilidad al cáncer heredado". J Zhejiang Univ Sci B 9 (1): 1 – 4. Doi:10.1631/jzus.B073001. PMC2170461. PMID18196605.
- ^ Perera FP (noviembre de 1997). "Medio ambiente y cáncer: ¿Quiénes son susceptibles?". Ciencia 278 (5340): 1068 – 73. Bibcode:1997Sci...278,1068 P. Doi:10.1126/science.278.5340.1068. PMID9353182.
- ^ Randall, pp, 93-94
- ^ Kehe K, Balszuweit F, Steinritz D, Thiermann H (septiembre de 2009). "Toxicología molecular de la inflamación cutánea inducida por mostaza de azufre y ampollas". Toxicología 263 (1): 12 – 9. Doi:10.1016/j.Tox.2009.01.019. PMID19651324.
- ^ a b c d Malhotra V, Perry MC (2003). "La quimioterapia clásica: mecanismos, la toxicidad y la ventana terapéutica". Cancer Biol Ther. 2 (4, Suppl 1): S2 – 4. PMID14508075.
- ^ Makin G, Hickman JA (julio de 2000). "Quimioterapia Apoptosis y cáncer". Res de tejido celular. 301 (1): 143 – 52. Bibcode:1994RSPTB.345...319H. Doi:10.1007/s004419900160. PMID10928287.
- ^ a b c d e f Corrie PG, Pippa G. (2008). "Quimioterapia citotóxica: aspectos clínicos". Medicina 36 (1): 24 – 28. Doi:10.1016/j.mpmed.2007.10.012.
- ^ a b Siddik ZH (2005). Mecanismos de acción de los agentes quimioterapéuticos cáncer: DNA-agentes alquilantes y fármacos antitumorales basados en platino interactivo. John Wiley & Sons, Ltd. Doi:10.1002/0470025077.chap84b.
- ^ a b c d e f Lind M.J., M.J. (2008). "Principios de quimioterapia citotóxica". Medicina 36 (1): 19 – 23. Doi:10.1016/j.mpmed.2007.10.003.
- ^ a b c Damia G, d ' Incalci M (septiembre de 1998). "Mecanismos de resistencia a los agentes alquilantes". Cytotechnology 27 (1 – 3): 165-73. Doi:10.1023 / A:1008060720608. PMC3449574. PMID19002790.
- ^ Takimoto CH, E. Calvo"Principios de la farmacoterapia oncológica" en Pazdur R, Wagman LD, KA Camphausen, Hoskins WJ (Eds.) El manejo del cáncer: Un enfoque multidisciplinario. 11 ed. 2008.
- ^ a b c Parker WB (julio de 2009). "Enzimología de purinas y pirimidinas antimetabolitos utilizados en el tratamiento del cáncer". Chem Rev. 109 (7): 2880 – 93. Doi:10.1021/cr900028p. PMC2827868. PMID19476376.
- ^ a b Madera, p. 11
- ^ a b c d e f g h i Airley, págs. 55-59
- ^ Adjei AA (junio de 2004). "El Pemetrexed (ALIMTA), un agente antineoplásico novela multitargeted". Clin. Cancer Res. 10 (12 Pt 2): 4276s – 4280s. Doi:10.1158/1078-0432.CCR-040010. PMID15217974.
- ^ AJ Wagstaff, ASST T, Goa KL (2003). "La capecitabina: una revisión de su farmacología y eficacia terapéutica en el manejo de avanzado cáncer de mama". Drogas 63 (2): 217 – 36. Doi:10.2165/00003495-200363020-00009. PMID12515569.
- ^ Rowinsky EK, Donehower RC (octubre de 1991). La farmacología clínica y uso de agentes antimitótica en quimioterapia del cáncer. Pharmacol. Ther. 52 (1): 35 – 84. Doi:10.1016/0163-7258 (91) 90086-2. PMID1687171.
- ^ a b c d Guo Yue QX, Liu X, DA (agosto de 2010). "Productos naturales microtubule-obligatorios para el tratamiento del cáncer". Planta Med. 76 (11): 1037 – 43. Doi:10.1055/s-0030-1250073. PMID20577942.
- ^ Damayanthi Y, Lown JW (junio de 1998). "Podophyllotoxins: estado actual y las últimas novedades". Curr. Chem Med. 5 (3): 205 – 52. PMID9562603.
- ^ Liu YQ, Yang L, Tian X, Cong (2007). "Podofilotoxina: perspectivas actuales". Compuestos bioactivos curr 3 (1): 37 – 66. Doi:10.1016/j.jallcom.2006.06.070.
- ^ Lodish H, Berk A, Zipursky SL, et al (2000). Biología molecular de la célula. 4ª edición. El papel de Topoisomerasas en la replicación del ADN. Nueva York: W. H. Freeman.
- ^ Goodsell DS (2002). "La perspectiva molecular: Topoisomerasas de ADN". Células madre 20 (5): 470 – 1. Doi:10.1634/stemcells.20-5-470. PMID12351817.
- ^ Nitiss JL (mayo de 2009). "Objetivos de ADN topoisomerasa II en quimioterapia contra el cáncer". Naturaleza comentarios cáncer 9 (5): 338 – 50. Doi:10.1038/nrc2607. PMC2748742. PMID19377506.
- ^ G Minotti, Menna P, E Salvatorelli, Cairo G, Gianni L (junio de 2004). "Las antraciclinas: moleculares avances y novedades farmacológicas en actividad antitumoral y cardiotoxicidad". Pharmacol. Rev. 56 (2): 185 – 229. Doi:10.1124/PR.56.2.6. PMID15169927.
- ^ Sobell HM (agosto de 1985). «Transcripción actinomicina y ADN». Proc. nacional Acad. Sci U.S.A. 82 (16): 5328 – 31. Doi:10.1073/pnas.82.16.5328. PMC390561. PMID2410919.
- ^ Dorr RT (abril de 1992). "Farmacología de bleomicina: mecanismo de acción y resistencia y farmacocinética clínica". Semin. Oncology. 19 (2 Suppl 5): 3 – 8. PMID1384141.
- ^ Airley, p. 87
- ^ Verweij J, Pinedo HM (octubre de 1990). "Mecanismo del mitomycin C: de acción, utilidad y limitaciones". Drogas anticáncer 1 (1): 5-13. Doi:10.1097/00001813-199010000-00002. PMID2131038.
- ^ Madera, págs. 17-18
- ^ Perry, p. 42
- ^ Epstein RJ (agosto de 2005). "El tratamiento de mantenimiento para suprimir micrometástasis: el nuevo desafío para el tratamiento adyuvante del cáncer". Clin. Cancer Res. 11 (15): 5337 – 41. Doi:10.1158/1078-0432.CCR-05-0437. PMID16061845.
- ^ Skeel, R. T. (2003). Manual de quimioterapia contra el cáncer (libro en rústica) (6ª ed.). Lippincott Williams & Wilkins. ISBN0-7817-3629-3.
- ^ Chabner, B.; Longo, D. L. (2005). Quimioterapia para el cáncer y bioterapia: principios y práctica (4ª ed.). Philadelphia: Lippincott Willians & Wilkins. ISBN0-7817-5628-6.
- ^ Du Bois D; Du Bois EF. Una fórmula para calcular la superficie aproximada si se conocen altura y peso. 1916. 5 (5). archivos de medicina interna. págs. 303 – 11.
- ^ a b c A. Felici; J. Verweij; A. Sparreboom (2002). Estrategias para las drogas anticáncer de dosificación: el bien, la zona mala y superficie corporal 38 (13). Eur J cáncer. págs. 1677 – 84.
- ^ a b c Kaestner SA, Sewell GJ (febrero de 2007). "Quimioterapia dosis parte I: bases científicas para la práctica actual y el uso de área de superficie corporal". Clin Oncol (R Coll Radiol) 19 (1): 23-37. Doi:10.1016/j.clon.2006.10.010. PMID17305252.
- ^ Donald Pinkel (agosto de 1958). El uso del área de superficie corporal como un criterio de dosificación de medicamentos en la quimioterapia contra el cáncer 18 (7). Cancer res. pp. 853 – 6.
- ^ a b Camilla H (abril de 2002). "Cómo calcular la dosis de quimioterapia". Br. J. Cancer 86 (8): 1297 – 302. Doi:10.1038/sj.BJC.6600139. PMC2375356. PMID11953888.
- ^ a b Beumer JH, Chu E, Salamone SJ (noviembre de 2012). "Dosis de quimioterapia basada en área de superficie corporal: apropiada en el siglo XXI?". J. Clin. Oncology. 30 (31): 3896 – 7. Doi:10.1200/JCO.2012.44.2863. PMID22965963.
- ^ a b Baker SD; Verweij J; Rowinsky EK; Donehower RC; JH Schellens; Grochow LB; Sparreboom A (2002). Papel de la superficie del cuerpo en la dosificación de agentes anticancerígenos en investigacion en adultos, 1991-2001 94 (24). J Natl Cancer Inst. pp. 1883 – 8.
- ^ a b c d e f g h i j Gamelin EC; Delva R; Jacob J; Merrouche Y; Raoul JL; Pezet D; Dorval E; Piot G; Morel A; Boisdron-Celle M (2008). Ajuste de la dosis individual fluorouracilo basado en seguimiento farmacocinético en comparación con dosis convencionales: resultados de un estudio multicéntrico aleatorizado de pacientes con cáncer colorrectal metastásico 26 (13). J Clin Oncol. págs. 2099 – 2105.
- ^ Saam J; Critchfield GC; Hamilton SA; Roa BB; Wenstrup RJ; Kaldate RR (2011). Superficie del cuerpo una dosis de 5-fluorouracilo resultados amplia variabilidad Interindividual en exposición 5-fluorouracilo en pacientes con cáncer colorrectal en los regímenes FOLFOX basada en área 10 (3). Clin Cancer colorrectal. págs. 203-206.
- ^ a b c d e f g Capitain O; Asevoaia A; Boisdron-Celle M; Poirier AL; Morel A; E Gamelin (2012). Dosis individuales fluorouracilo en FOLFOX basado en seguimiento farmacocinético compararon con dosis de superficie del cuerpo-área convencional: un estudio de fase II, Proof-of-Concept 11 (4). Clin Cancer colorrectal. págs. 263-267.
- ^ Kaldate RR; Haregewoin A; Grier CE; Hamilton SA; McLeod HL. Modelando el 5-fluorouracilo área bajo la curva versus relación entre dosis y para desarrollar un algoritmo de dosificación farmacocinético para pacientes con cáncer colorrectal recibiendo FOLFOX6 17 (3). oncólogo, 2012. págs. 296-302.
- ^ a b c Hunter RJ, Navo MA, Thaker PH, Bodurka DC, lobo JK, Smith JA (febrero de 2009). "Dosificación de la quimioterapia en pacientes obesos: real contra el área de superficie corporal asignado (BSA)". Tratamiento del cáncer. Rev. (Cancer Treat Rev) 35 (1): 69-78. Doi:10.1016/j.CTRV.2008.07.005. PMID18922643.
- ^ Macbeth, p. 4
- ^ Buffery, PJ; Allen, KM; Chin, PKL; Moore, GA; Barclay, ML; Begg, EJ (2014). Experiencia ¿trece años de monitorización farmacocinética y dosis de Busulfan: puede mejorar la estrategia? 36 (1). Ther Drug Monit. págs. 86-92.
- ^ Bartelink IH; Bredius RG; Belitser SV; Suttorp m m; Bierings M; Knibbe CA; Egeler M; Lankester AC; Egberts AC; Zwaveling J; Boelens JJ. Asociación entre la exposición de busulfán y resultado en los niños que reciben Busulfan intravenosa antes del trasplante de células madre hematopoyéticas 36 (1). Ther Drug Monit. págs. 93 – 99.
- ^ "Ensayo de metotrexato ™ ARK". Diagnostico de Arca.
- ^ "Personalizando la quimioterapia para curar el cáncer mejor". Diagnóstico de mi atención.
- ^ "Una breve historia de la BSA dosificación". Diagnóstico de mi atención.
- ^ Madera, Miriam; David Brighton (2005). El manual del Royal Marsden Hospital de quimioterapia contra el cáncer: una guía para el equipo multidisciplinario. St. Louis, Mo: Elsevier Churchill Livingstone. págs. 93-94. ISBN0-443-07101-2.
- ^ Madera, págs. 113-118
- ^ Moreno-Ramirez D, de la Cruz-Merino L, Ferrandiz L, Villegas-Portero R, García Nieto un (2010). "Aislado de perfusión de la extremidad para melanoma maligno: revisión sistemática sobre la efectividad y la seguridad". Oncólogo 15 (4): 416 – 27. Doi:10.1634/theoncologist.2009-0325. PMC3227960. PMID20348274.
- ^ Verhoef C, marchitez de JH, diez Hagen TL, Eggermont AM (octubre de 2008). "Perfusión hepática aislada para el tratamiento de los tumores hepáticos: atardecer o amanecer?". Surg. Oncol. Clin. N. Am. 17 (4): 877 – 94, xi. Doi:10.1016/j.soc.2008.04.007. PMID18722924.
- ^ Hendriks JM, Van seguro PE (1998). "Aislado de la perfusión pulmonar para el tratamiento de las metástasis pulmonares". Surg Oncol 7 (1 – 2): 59-63. Doi:10.1016/S0960-7404 (98) 00028-0. PMID10421507.
- ^ Chitwood K, Etzkorn J, Cohen G (septiembre de 2013). "Tratamiento tópico e intralesional de cáncer de piel no melanoma: comparaciones eficacia y coste". Cirugía dermatológica: publicación oficial de la sociedad americana para la cirugía dermatológica [et al.] 39 (9): 1306 – 16. Doi:10.1111/DSU.12300. PMID23915332.
- ^ Airley, p. 265
- ^ Huang, p. 130
- ^ Elad S, Zadik Y Hewson Hovan A, Correa ME, Logan R, Elting LS, Spijkervet FK, Brennan MT (agosto de 2010). "Una revisión sistemática de las infecciones virales asociadas con la implicación oral en pacientes con cáncer: un foco Herpesviridea". Apoyo atención de cáncer 18 (8): 993 – 1006. Doi:10.1007/s00520-010-0900-3. PMID20544224.
- ^ "Coriolus Versicolor". Cancer.org. 2008-06-10. 07 de agosto de 2012.
- ^ PMID 16319675
- ^ a b Keidan RD, Fanning J, RA Gatenby, Weese JL (Mar de 1989). "Tiflitis recurrente. Una enfermedad resultante de una quimioterapia agresiva". Dis Colon recto 32 (3): 206 – 9. Doi:10.1007/BF02554529. PMID2920627.
- ^ Gibson RJ, Keefe DM (septiembre de 2006). "Cáncer inducidos por quimioterapia diarrea y estreñimiento: mecanismos de estrategias de prevención y daños". Apoyo atención de cáncer 14 (9): 890 – 900. Doi:10.1007/s00520-006-0040-y. PMID16604351.
- ^ Groopman JE, Itri LM (octubre de 1999). "La anemia inducida por la quimioterapia en adultos: incidencia y tratamiento". J. nacional Cancer Inst. 91 (19): 1616 – 34. Doi:10.1093/jnci/91.19.1616. PMID10511589.
- ^ Henry DH (julio de 2006). "El papel del hierro intravenoso en la anemia relacionada con el cáncer". Oncología (Williston Park, N.Y.) 20 (8 Suppl 6): 21 – 4. PMID16925107.
- ^ Rodgers GM, Becker PS, Bennett CL, Cella D, Chanan-Khan A, Chesney C, C Cleeland, Coccia PF, Djulbegovic B, Garst JL, Gilreath JA, Kraut EH, Lin WC, Matulonis U, Millenson M, Reinke D, Rosenthal J, Sabbatini P, Schwartz RN, Stein RS, Vij R (julio de 2008). "El cáncer y la quimioterapia-inducida por la anemia". J Natl Compr Canc Netw 6 (6): 536 – 64. PMID18597709.
- ^ S Vadhan-Raj (enero de 2009). "Gestión de la trombocitopenia inducida por la quimioterapia: estado actual de los agentes thrombopoietic". Semin. Hematology /. 46 (1 Suppl 2): S26 – 32. Doi:10.1053/j.seminhematol.2008.12.007. PMID19245931.
- ^ Sekhon SS, Roy V (mayo de 2006). "Trombocitopenia en adultos: un enfoque práctico para la evaluación y manejo". Hacia el sur. J. med. 99 (5): 491 – 8; el concurso 499 – 500, 533. Doi:10.1097/01.SMJ.0000209275.75045.D4. PMID16711312.
- ^ Berger AM, Abernethy AP, Atkinson A, Barsevick AM, Breitbart WS, Cella D, B Cimprich, C Cleeland, MA Eisenberger, Escalante CP, Jacobsen PB, Kaldor P, Ligibel JA, Murphy BA, o ' Connor T, Pirl WF, Rodler E, Rugo HS, Thomas J, Wagner LI (agosto de 2010). "La fatiga relacionada con el cáncer". J Natl Compr Canc Netw 8 (8): 904 – 31. PMID20870636.
- ^ DJ Franklin, Packel L (marzo de 2006). "La fatiga relacionada con el cáncer". Arch Phys Med Egido 87 (3 Suppl 1): S91 – 3; el concurso S94 – 5. Doi:10.1016/j.APMR.2005.12.015. PMID16500197.
- ^ Calambre F, Byron-Daniel J (2012). "Ejercicio para el tratamiento de la fatiga relacionada con el cáncer en adultos". En calambre, Fiona. Cochrane Database Syst Rev 11:: CD006145. Doi:10.1002/14651858.CD006145.pub3. PMID23152233.
- ^ Gill, Paula; Grothey, Axel; Transfusional, Charles (2006). "Náuseas y vómitos en el paciente con cáncer". Oncología:: 1482 – 1496. Doi:10.1007/0-387-31056-8_83. ISBN978-0-387-24291-0. 02 de septiembre de 2011. "Náuseas y los vómitos son dos de los más temidos cáncer relacionados con el tratamiento efectos secundarios para los pacientes con cáncer y sus familias".
- ^ Chadha V, Shenol SD (2003). "Pérdida del cabello en pacientes con cáncer de quimioterápicos". Diario indio de Dermatología y Venereología leprología 69 (2): 131-132. PMID17642856.
- ^ Lemieux J (2012). "Reducir la alopecia inducida por la quimioterapia con enfriamiento del cuero cabelludo". Avances clínicos en hematología y Oncología: H & O 10 (10): 681-682. PMID23187775.
- ^ Shapiro J, precio VH (1998). "Rebrote de cabello. Agentes terapéuticos". Clínicas dermatológicas 16 (2): 341-356. Doi:10.1016/S0733-8635 (05) 70017-6. PMID9589208.
- ^ Al-Mohanna H, S Al-Khenaizan (2010). "Alopecia permanente tras irradiación craneal en un niño". Journal de medicina cutánea y cirugía 14 (3): 141-143. PMID20487675.
- ^ Puede G, Demir M, Erol O, Aydiner A (2012). "Una comparación de las experiencias de hombres y mujeres de la alopecia inducida por la quimioterapia". Revista Europea de Enfermería oncológica. Doi:10.1016/j.Ejon.2012.06.003. PMID22901547.
- ^ Trüeb RM (marzo de 2009). "Alopecia inducida por la quimioterapia". Semin Cutan Med Surg 28 (1): 11 – 4. Doi:10.1016/j.Sder.2008.12.001. PMID19341937.
- ^ John Geddes SY, campeón RW, ER, Rashid RM (julio de 2012). "Alopecia inducida por la quimioterapia". J. soy Acad. Dermatol. 67 (1): e37 – 47. Doi:10.1016/j.jaad.2011.02.026. PMID22178150.
- ^ U. Rüther, C. Nunnensiek, H.-J. Schmoll,Neoplasias secundarias después de quimioterapia, radioterapia y la inmunosupresiónContribuciones a la Oncología (Beiträge zur Onkologie); Vol 55, 2000, ISBN 3-8055-7116-X
- ^ Hijiya N, m Hudson, Lensing S, Zacher M, Onciu M, Behm FG, Razzouk BI, Ribeiro RC, Rubnitz JE, Sandlund JT, Rivera GK, Evans nos, MV Relling, Pui CH (2007). "Incidencia acumulativa de neoplasmas secundarios como un primer evento después de la leucemia linfoblástica aguda infantil". JAMA 297 (11): 1207 – 1215. Doi:10.1001/Jama.297.11.1207. PMID17374815.
- ^ a b c d Brydøy M, Fosså SD, O Dahl, Bjøro T (2007). "Gonadales problemas de disfunción y fertilidad en sobrevivientes de cáncer". Acta Oncol 46 (4): 480 – 9. Doi:10.1080/02841860601166958. PMID17497315.
- ^ a b Morgan S, RA Anderson, C Gourley, Wallace WH, Spears N (2012). "¿Cómo los agentes quimioterapéuticos dañe el ovario?". Zumbido. Reprod. Actualización 18 (5): 525 – 35. Doi:10.1093/humupd/dms022. PMID22647504.
- ^ GURGAN T, Salman C, Demirol (octubre de 2008). "Embarazo y técnicas de reproducción asistida en hombres y mujeres después de tratamiento contra el cáncer". Placenta. 29 Suppl B: 152 – 9. Doi:10.1016/j.placenta.2008.07.007. PMID18790328.
- ^ Courbiere, B.; Decantador, C.; Portador-Deutsch, S.; Rives, N.; Mirallie, S.; Pech, J. C.; De Ziegler, D.; Carre-Paloma, f el.; Mayo-Panloup, P.; SIFER, C.; Amice, V.; Schweitzer, T.; Porcu-Buisson, G.; Poirot, C. (2013). "Emergencia FIV para embrión congelado para preservar la fertilidad de la mujer: un estudio de cohortes multicéntrico francés". Reproducción humana 28 (9): 2381. Doi:10.1093/humrep/det268.
- ^ André Tichelli, Alicia Rovó. Ediciones de la fertilidad después del trasplante de células madre hematopoyéticas. Expert Rev Hematol. 2013; 6 (4): 375-388.
A su vez citando: Sanders JE, Hawley J, Levy W et al. embarazos después de altas dosis de ciclofosfamida con o sin la alto-dosis busulfán o trasplante de médula y la irradiación total del cuerpo " Sangre 87(7), 3045–3052(1996). - ^ a b c d e f Arnon J, Meirow D, Lewis-Roness H, Ornoy A (2001). "Genéticos y teratogénicos efectos de tratamientos contra el cáncer en gametos y embriones". Actualización de la reproducción humana 7 (4): 394 – 403. Doi:10.1093/humupd/7.4.394. PMID11476352. [1]
- ^ a b Pino del BM. Neuropatía periférica inducida por la quimioterapia. NCI Cancer Bulletin. 23 de febrero de 2010; 4:6.
- ^ Grisold W, S Oberndorfer, Windebank AJ. Quimioterapia y polineuropatías. Asociación Europea de la revista Neurooncology. 2012;12(1).
- ^ https://www.ehealthme.com/DS/Herceptin/Peripheral%20sensory%20neuropathy
- ^ Beijers AJM, Jongen, Jim & g Vreugdenhil1. [2]. El diario de países bajos de la medicina. Enero 2012;70(1). PMID 22271810.
- ^ a b Windebank AJ & neuropatía inducida por la quimioterapia W. Grisold. Diario del sistema nervioso periférico. 2008 mar; 1:27:46. PMID 18346229.
- ^ Savage L. Dolor inducida por la quimioterapia rompecabezas científicos. Journal of the National Cancer Institute. 2007; 99 (14): 1070 – 1071.
- ^ Tannock si, Ahles TA, Ganz PA, Van Dam FS (junio de 2004). "Deterioro cognitivo asociado a quimioterapia para el cáncer: informe de un taller". J. Clin. Oncology. 22 (11): 2233 – 9. Doi:10.1200/JCO.2004.08.094. PMID15169812.
- ^ Madera, p. 202
- ^ Shaikh AY, Shih JA (junio de 2012). "Cardiotoxicidad inducida por la quimioterapia". Curr corazón Fail Rep 9 (2): 117 – 27. Doi:10.1007/s11897-012-0083-y. PMID22382639.
- ^ Thatishetty AV, Agresti N, o ' Brien CB (2013). "La hepatotoxicidad inducida por la quimioterapia". Clínicas de la enfermedad hepática 17 (4): 671 – 86, ix-x. Doi:10.1016/j.CLD.2013.07.010. PMID24099024.
- ^ PD rey, Perry MC (2001). "La hepatotoxicidad de la quimioterapia". Oncólogo 6 (2): 162 – 76. Doi:10.1634/theoncologist.6-2-162. PMID11306728.
- ^ de Jonge MJ, Verweij J (febrero de 2006). "Toxicidad renal de la quimioterapia". Semin. Oncology. 33 (1): 68-73. Doi:10.1053/j.seminoncol.2005.11.011. PMID16473645.
- ^ Humphreys BD, Soiffer RJ, Magee CC (enero de 2005). "Insuficiencia renal asociada con el cáncer y su tratamiento: una actualización". J Am Soc Nephrol. 16 (1): 151 – 61. Doi:10.1681/ASN.2004100843. PMID15574506.
- ^ Brock PR, caballero KR, Freyer DR, Campbell KC Steyger PS, BW Blakley, Rassekh SR, Chang KW, Fligor BJ, Rajput K, Sullivan M, Neuwelt EA (julio de 2012). "Ototoxicidad inducida por el platino en niños: una revisión de consenso sobre los mecanismos, predisposición y protección, incluyendo una nueva escala de ototoxicidad de la sociedad internacional de oncología pediátrica Boston". J. Clin. Oncology. 30 (19): 2408 – 17. Doi:10.1200/JCO.2011.39.1110. PMC3675696. PMID22547603.
- ^ Rybak LP, Mukherjea D, S Jajoo, Ramkumar V (noviembre de 2009). "Cisplatino ototoxicidad y protección: estudios clínicos y experimentales". Tohoku j exp Med. 219 (3): 177 – 86. Doi:10.1620/tjem.219.177. PMC2927105. PMID19851045.
- ^ Semanas JC, Catalano PJ, Cronin A, MD Finkelman, Mack JW, Keating NL, Schrag D (octubre de 2012). "Expectativas de los pacientes acerca de los efectos de la quimioterapia para el cáncer avanzado". N. Engl. J. Med. 367 (17): 1616 – 25. Doi:10.1056/NEJMoa1204410. PMC3613151. PMID23094723.
- ^ Deeken JF, Löscher W (marzo de 2007). "La barrera hemato - encefálica y cáncer: los transportadores, el tratamiento y caballos de Troya". Clin. Cancer Res. 13 (6): 1663 – 74. Doi:10.1158/1078-0432.CCR-06-2854. PMID17363519.
- ^ Agarwala SS, Kirkwood JM (2000). "La temozolomida, una novela agente alquilante con actividad en el sistema nervioso central, puede mejorar el tratamiento del melanoma metastásico avanzado". Oncólogo 5 (2): 144 – 51. Doi:10.1634/theoncologist.5-2-144. PMID10794805.
- ^ Gerstner ER, bien RL (junio de 2007). "Aumenta la permeabilidad de la barrera blood - brain a la quimioterapia en los tumores cerebrales metastásicos: establecer un paradigma de tratamiento". J. Clin. Oncology. 25 (16): 2306 – 12. Doi:10.1200/JCO.2006.10.0677. PMID17538177.
- ^ Minchinton AI, Tannock IF (agosto de 2006). "Penetración en tumores sólidos de la droga". Naturaleza comentarios cáncer 6 (8): 583 – 92. Doi:10.1038/nrc1893. PMID16862189.
- ^ Nastoupil LJ, Rosa AC, flores CR (mayo de 2012). "Linfoma de células B grandes difuso: enfoques actuales de tratamiento". Oncología (Williston Park, N.Y.) 26 (5): 488 – 95. PMID22730604.
- ^ Freedman (de octubre). "Linfoma folicular: 2012 actualización de diagnóstico y tratamiento". Diario americano de la hematología 87 (10): 988 – 95. Doi:10.1002/AJH.23313. PMID23001911.
- ^ Rampling R, James A, Papanastassiou V (junio de 2004). "El presente y el futuro manejo de tumores cerebrales malignos: cirugía, radioterapia, quimioterapia". Revista de Neurología, Neurocirugía y psiquiatría. 75 Suppl 2 (Suppl 2): ii24 – 30. Doi:10.1136/jnnp.2004.040535. PMC1765659. PMID15146036.
- ^ Madan V, Lear JT, Szeimies RM (20 de febrero de 2010). "Cáncer de piel no melanoma". The Lancet 375 (9715): 673 – 85. Doi:10.1016/S0140-6736 (09) 61196-X. PMID20171403.
- ^ Goldman B (febrero de 2003). "Multirresistencia: nuevos fármacos ayudará a puntuación de quimioterapia contra el cáncer?". J. nacional Cancer Inst. 95 (4): 255 – 7. Doi:10.1093/jnci/95.4.255. PMID12591977.
- ^ E. Crowley, CA. McDevitt, R. Callaghan (2009). Multirresistencia en cáncer. Generación de inhibidores de la P-glicoproteína: ¿hacia dónde, ahora?. Protocolos de Springer. págs. 405-432.
- ^ Luqmani ti (2005). "Mecanismos de resistencia a los medicamentos de quimioterapia contra el cáncer". Med Princ Pract. 14 Suppl 1: 35 – 48. Doi:10.1159/000086183. PMID16103712.
- ^ DE Gerber (febrero de 2008). "Terapias dirigidas: una nueva generación de tratamientos contra el cáncer". Soy médico Fam 77 (3): 311 – 9. PMID18297955.
- ^ Allen TM (octubre de 2002). "Orientada por ligando terapéutica en terapia contra el cáncer". Naturaleza comentarios cáncer 2 (10): 750 – 63. Doi:10.1038/nrc903. PMID12360278.
- ^ Chen HX, mira JN (agosto de 2009). "Los efectos adversos de agentes anticancerosos dirigidos a la vía de VEGF". Naturaleza comentarios sobre oncología clínica 6 (8): 465 – 77. Doi:10.1038/nrclinonc.2009.94. PMID19581909.
- ^ Zhang J, Yang PL, Gray NS (enero de 2009). "Objetivos de cáncer con inhibidores de la cinasa de molécula pequeña". Naturaleza comentarios cáncer 9 (1): 28-39. Doi:10.1038/nrc2559. PMID19104514.
- ^ a b Chidambaram M, Manavalan R, Kathiresan K (2011). "Nanotherapeutics a superar las limitaciones de la quimioterapia convencional contra el cáncer". J Pharm Pharm Sci 14 (1): 67-77. PMID21501554.
- ^ a b Teicher BA, Chari RV (octubre de 2011). "Terapéutica conjugada de anticuerpo: desafíos y posibilidades". Clin. Cancer Res. 17 (20): 6389 – 97. Doi:10.1158/1078-0432.CCR-11-1417. PMID22003066.
- ^ Sievers EL, Linenberger M (noviembre de 2001). "Mylotarg: quimioterapia orientada por anticuerpo viene de la edad". Current Opinion in Oncology 13 (6): 522 – 7. Doi:10.1097/00001622-200111000-00016. PMID11673694.
- ^ FDA. "Mylotarg (gemtuzumab ozogamicina): retirada del mercado". 18 de agosto de 2013.
- ^ Vides T, T Faunce (mayo de 2009). "Evaluación de la seguridad y la rentabilidad de nanofármacos temprano". Ley J Med 16 (5): 822 – 45. PMID19554862.
- ^ Heller R, Gilbert R, Jaroszeski MJ (1999). "Aplicaciones clínicas de electrochemotherapy". ADV Drug Deliv Rev 35 (1): 119 – 129. Doi:10.1016/S0169-409 X (98) 00067-2. PMID10837693.
- ^ JO Larkin, Collins CG, Aarons S, Tangney M, Whelan M, o ' Reily S, O Breathnach, Soden DM, o ' Sullivan GC (2007). "Electrochemotherapy - aspectos del desarrollo preclínico y experiencia clínica temprana". Ann Surg 245 (3): 469-479. Doi:10.1097/01.SLA.0000250419.36053.33. PMC1877027. PMID17435555.
- ^ a b Marty M, Sersa G, Garbay JR, Gehl J, Collins CG, Snoj M, V Billard, PF Geertsen, JO Larkin, Miklavcic D, Pavlovic yo, Paulin-Kosir SM, Cemazar M, Morsli N, Soden DM, Rudolf Z, Robert C, o ' Sullivan GC, Mir LM (2006). "Electrochemotherapy - un tratamiento de las metástasis cutáneas y subcutáneas sumamente fácil, efectivo y seguro". EUR J Cancer Suppl 4 (11): 3 – 13. Doi:10.1016/j.ejcsup.2006.08.002.
- ^ Sersa G, Miklavcic D, Cemazar M, Rudolf Z, Pucihar G, Snoj M (2008). "Electrochemotherapy en el tratamiento de tumores". EUR J Surg Oncol 34 (2): 232-240. Doi:10.1016/j.ejso.2007.05.016. PMID17614247.
- ^ Möller MG, Salwa S, Soden DM, o ' Sullivan GC (2009). "Electrochemotherapy como un complemento o una alternativa a otros tratamientos para el melanoma no resecable o en tránsito". Expert Rev Ther anticáncer 9 (11): 1611 – 1630. Doi:10.1586/era.09.129. PMID19895245.
- ^ Testori A Tosti G C Martinoli, Spadola G, Cataldo F, Verrecchia F, F Baldini, Mosconi M, Soteldo J, Tedeschi I, C Passoni, Pari C, Di Pietro A, Ferrucci PF (2010). "Electrochemotherapy para las lesiones cutáneas y subcutáneas del tumor: un nuevo enfoque terapéutico". Dermatol Ther 23 (6): 651 – 661. Doi:10.1111/j.1529-8019.2010.01370.x. PMID21054709.
- ^ Hampton T (2011). "Impulsos eléctricos ayudan con quimioterapia, mayo abre nuevos caminos para otros agentes". JAMA 305 (6): 549-551. Doi:10.1001/Jama.2011.92. PMID21304073.
- ^ Mir LM, Gehl J, Sersa G, Collins CG, Garbay JR, Billard V, PF Geertsen, Rudolf Z, GC o ' Sullivan, Marty M (2006). "Procedimientos operativos estándar de la electrochemotherapy: instrucciones para el uso de bleomicina o cisplatino administrado sistémicamente o localmente y pulsos eléctricos entregados por la CliniporatorTM por medio de electrodos invasivos o no invasivo". EUR J Cancer Suppl 4 (11): 14-25. Doi:10.1016/j.ejcsup.2006.08.003.
- ^ DM Soden, Larkin JO Collins CG, Tangney M, Aarons S, J Piggott, Morrissey A, Dunne C, o ' Sullivan GC (2006). "La aplicación exitosa de electrochemotherapy específica utilizando electrodos flexibles novela y bleomicina dosis baja para tumores sólidos". Cáncer Lett 232 (2): 300-310. Doi:10.1016/j.canlet.2005.03.057. PMID15964138.
- ^ Miklavcic D, Snoj M, Zupanic A, B Kos, Cemazar M, Kropivnik M, Bracko M, Pecnik T, Gadzijev E, Sersa G (2010). "Hacia la planificación del tratamiento y el tratamiento de tumores sólidos profundamente arraigados por electrochemotherapy". BioMed Eng en línea 9 (1): 10. Doi:10.1186/1475-925 X-9-10. PMC2843684. PMID20178589.
- ^ Issels, R. (1999). "Hipertermia combinada con quimioterapia – fundamentos biológicos, aplicación clínica y resultados del tratamiento". Onkologie 22 (5): 374-381. Doi:10.1159/000026986.
- ^ a b Ben-Ari ET (abril de 2004). "Doble propósito: algunas terapias contra el cáncer usados para tratar enfermedades autoinmunes". J. nacional Cancer Inst. 96 (8): 577 – 9. Doi:10.1093/jnci/96.8.577. PMID15100330.
- ^ a b M Cutolo, Sulli A, C Pizzorni, Seriolo B, Straub RH (agosto de 2001). "Los mecanismos antiinflamatorios del metotrexato en la artritis reumatoide". Ann Rheum. Dis. 60 (8): 729-35. Doi:10.1136/ARD.60.8.729. PMC1753808. PMID11454634.
- ^ Montaudié H, Sbidian E, Paul C, Maza A, Gallini A, Aractingi S, Aubin F, Bachelez H, B Cribier, Joly P, D Jullien, Le Maître M, miseria L, Richard MA, Ortonne JP (mayo de 2011). "Methotrexate en psoriasis: una revisión sistemática de las modalidades del tratamiento, incidencia, factores de riesgo y control de toxicidad en el hígado". J Eur Acad Dermatol Venereol. 25 Suppl 2: 8 – 12. Doi:10.1111/j.1468-3083.2011.03991.x. PMID21388454.
- ^ a b Chen J, J Veras milímetros, Liu C, Lin (2013). "Metotrexato para la espondilitis anquilosante". En Chen, Junmin. Cochrane Database Syst Rev 2:: CD004524. Doi:10.1002/14651858.CD004524.pub4. PMID23450553.
- ^ a b O gris, McDonnell GV, Forbes RB (2004). "El metotrexato para la esclerosis múltiple". En gris, Orla. Cochrane Database Syst Rev (2): CD003208. Doi:10.1002/14651858.CD003208.pub2. PMID15106195.
- ^ a b OM gris, McDonnell GV, Forbes RB (agosto de 2006). "Una revisión sistemática de metotrexato oral para la esclerosis múltiple". Mult. Scler. 12 (4): 507 – 10. Doi:10.1191/1352458506ms1299oa. PMID16900766.
- ^ Ntali S, Bertsias G, Boumpas DT (junio de 2011). "Ciclofosfamida y lupus nefritis: Cuándo, cómo, por cuánto tiempo?". Clin Rev Allergy Immunol 40 (3): 181-91. Doi:10.1007/s12016-009-8196-0. PMID20107927.
- ^ Bacigalupo A K Ballen Rizzo D, S Giralt, Lázaro H, V Ho, Apperley J, Slavin S, Pasquini M, Sandmaier BM, Barrett J, Blaise D, Lowski R, Horowitz M (diciembre de 2009). "Definir la intensidad de los regímenes de acondicionamiento: definiciones de trabajo". Biología de trasplante de sangre y médula ósea: revista de la sociedad americana de sangre y trasplante de médula ósea 15 (12): 1628 – 33. Doi:10.1016/j.bbmt.2009.07.004. PMC2861656. PMID19896087.
- ^ "NIOSH exposición ocupacional a agentes antineoplásicos". Instituto Nacional de los Estados Unidos para la salud y seguridad ocupacional. 10 de octubre de 2007.
- ^ Madera, p. 38.
- ^ McKnight JA (mayo de 2003). "Principios de la quimioterapia". Clin Tech pequeños Anim Pract 18 (2): 67-72. Doi:10.1053/SVMs.2003.36617. PMID12831063.
- ^ a b c d e f g Rossi, S, ed. (2013). Manual de medicamentos australiano (2013 Ed.). Adelaida: El australiano medicamentos manual fiduciaria de la unidad. ISBN978-0-9805790-9-3.
- ^ a b c Comité conjunto Formulary (2013). British National Formulary (BNF) (65 Ed.). Londres: Prensa farmacéutica. ISBN978-0-85711-084-8.
- ^ Brunton, L; Chabner, B; Knollman, B (2010). Goodman y las bases farmacológicas Gilman de la terapéutica (12ª Ed.). Nueva York: McGraw-Hill Professional. ISBN978-0-07-162442-8.
- ^ a b c Alldredge BK, Corelli RL, Ernst Guglielmo BJ, Jacobson PA, Kradjan WA, Williams BR (febrero de 2012). Aplicación terapéutica: el uso clínico de fármacos. Koda Kimble y Youngs aplicado Therapeutics (10ª Ed.). Baltimore, MD: Lippincott Williams & Wilkins. ISBN978-1609137137.
- ^ Sweetman, S (Ed.). Martindale: La referencia completa de drogas. Londres: Prensa farmacéutica. 08 de febrero de 2014.
- ^ a b Momparler RL (agosto de 2012). "Una perspectiva sobre la actividad antileucémica comparativa de Aza-5-2'-desoxicitidina (Decitabina) y 5-AZACITIDINA (Vidaza)".. Productos farmacéuticos (Basilea, Suiza) 5 (8): 875 – 881. Doi:10.3390/ph5080875. PMC3763670. PMID24280679.
- ^ a b Estey EH (12 de junio de 2013). "Epigenética en la práctica clínica: los ejemplos de la azacitidina y la decitabina mielodisplasia y leucemia mieloide aguda". Leucemia 27 (9): 1803-1812. Doi:10.1038/Leu.2013.173. PMID23757301.
- ^ YJ Kim Jang JH, Kwak JY, Lee JH, Kim HJ (junio de 2013). "El uso de la azacitidina para los síndromes mielodisplásicos: temas polémicos y recomendaciones prácticas." (PDF). Investigación de sangre 48 (2): 87-98. Doi:10.5045/br.2013.48.2.87. PMC3698413. PMID23826577.
- ^ Platzbecker U, contaminando U (septiembre de 2013). "Combinación de la azacitidina y la lenalidomida en síndromes mielodisplásicos o mieloide aguda leucemia, un sabio enlace?". Leucemia 27 (9): 1813 – 9. Doi:10.1038/Leu.2013.140. PMID23644421.
- ^ Ritchie EK (2012). "Seguridad y eficacia de la azacitidina en el tratamiento de pacientes ancianos con síndrome mielodisplásico.. Intervenciones clínicas en el envejecimiento 7:: 165 – 73. Doi:10.2147/CIA.S24659. PMC3393359. PMID22791989.
- ^ Keating GM (28 de mayo de 2012). "La azacitidina: una revisión de su uso en el tratamiento de la leucemia mieloide aguda síndromes mielodisplásicos.". Drogas 72 (8): 1111 – 36. Doi:10.2165/11209430-000000000-00000. PMID22571445.
- ^ Martínez-Francés (junio de 2011). "Los efectos adversos de la azacitidina: Inicio, duración y tratamiento.". Avances en la terapia. 28 Suppl 4: 1 – 5. Doi:10.1007/s12325-011-0021-5. PMID21688206.
- ^ Letra P (marzo de 2011). "La azacitidina para el tratamiento de pacientes con leucemia mieloide aguda con ráfagas de 20-30% y displasia del multilineage.". Avances en la terapia. 28 Suppl 3: 1 – 9. Doi:10.1007/s12325-011-0002-8. PMID21431628.
- ^ Vigilia CE, T Martin-Santos, Garcia-Manero G (24 de septiembre de 2010). "Seguridad y eficacia de la azacitidina en síndromes mielodisplásicos".. La terapia, el desarrollo y diseño de fármacos 4:: 221 – 9. Doi:10.2147/DDDT.S3143. PMC2948932. PMID20957213.
- ^ McCormack SE, Warlick ED (07 de septiembre de 2010). "Enfoques epigenéticos en el tratamiento de los síndromes mielodisplásicos: utilidad clínica de la azacitidina.". OncoTargets y terapia 3:: 157 – 65. Doi:10.2147/OTT.S5852. PMC2939768. PMID20856790.
- ^ Martens, ed. (2010). "11 5-azacitidina/azacitidina". Pequeñas moléculas en Oncología. Resultados recientes en la investigación del cáncer 184. Heidelberg: Springer. PP. 159-170. Doi:10.1007/978-3-642-01222-8. ISBN978-3-642-01222-8.
- ^ Chintala, L; Vaka, S; Baranda, J; Williamson, SK (09 de abril de 2011). "La capecitabina versus 5-fluorouracilo en el cáncer colorrectal: dónde estamos?" (PDF). Comentarios sobre oncología 5 (2): 129-140. Doi:10.1007/s12156-011-0074-3.
- ^ Bang YJ (diciembre de 2011). "Capecitabina en cáncer gástrico". De expertos de la terapia contra el cáncer 11 (12): 1791 – 1806. Doi:10.1586/era.11.172. PMID22117147.
- ^ Hirsch BR, Zafar SY (2011). "La capecitabina en el manejo del cáncer colorrectal".. Investigación y manejo del cáncer 3:: 79-89. Doi:10.2147/CMR.S11250. PMC3097797. PMID21629830.
- ^ Quidde J, Arnold D, Stein A (2012). "Manejo clínico de cáncer de colon localizada con capecitabina.". Conocimientos de medicina clínica. Oncología 6:: 363 – 73. Doi:10.4137/CMO.S8194. PMC3498969. PMID23170068.
- ^ Fernández-Martos C, M Nogué, Cejas P, Moreno-García V, Machancoses, Feliu J (28 de mayo de 2012). "El papel de capecitabina en el tratamiento del cáncer rectal localmente avanzado: una actualización.". Drogas 72 (8): 1057 – 1073. Doi:10.2165/11633870-000000000-00000. PMID22621694.
- ^ Ma Y, Tang L, Wang HX, Xu YC, Ma Y Zhang FC (junio de 2012). "La capecitabina para el tratamiento para el cáncer gástrico avanzado: eficacia, seguridad y etnicidad.". Revista de Farmacia clínica y terapéutica 37 (3): 266-275. Doi:10.1111/j.1365-2710.2011.01289.x. PMID21950464.
- ^ O ' Shaughnessy JA, Kaufmann M, Siedentopf F, Dalivoust P, Debled M, Robert NJ, Harbeck N (2012). "La monoterapia con capecitabina: revisión de los estudios en cáncer de mama metastásico HER-2 negativo de primera línea.". El oncólogo 17 (4): 476 – 84. Doi:10.1634/theoncologist.2011-0281. PMC3336834. PMID22418569.
- ^ Petrelli F, Cabiddu M, Barni S (junio de 2012). "5-fluorouracilo o capecitabina en el tratamiento de cáncer colorrectal avanzado: un análisis agrupado de ensayos aleatorios.". Oncología Médica (Northwood, Londres, Inglaterra) 29 (2): 1020 – 1029. Doi:10.1007/s12032-011-9958-0. PMID21516482.
- ^ Barrios, CH (26 de enero de 2012). "El papel de capecitabina en cáncer de mama de etapa temprana". Informes actuales de cáncer de mama 4 (1): 22 – 29. Doi:10.1007/s12609-011-0067-z.
- ^ Comi G, Hartung HP, Kurukulasuriya NC, Greenberg SJ, Scaramozza M (enero de 2013). "La cladribina las tabletas para el tratamiento de la esclerosis múltiple recurrente-remitente.". Dictamen pericial sobre farmacoterapia 14 (1): 123 – 36. Doi:10.1517/14656566.2013.754012. PMID23256518.
- ^ a b Spurgeon S, Yu M, Phillips JD, Hepner EM (agosto de 2009). "La cladribina: no sólo otro análogo de purina?". Dictamen pericial sobre drogas en investigación 18 (8): 1169 – 81. Doi:10.1517/13543780903071038. PMID19604118.
- ^ Bagnato, F; Pirko, (octubre 2011). "Nuevos agentes y nuevas estrategias de tratamiento de la esclerosis múltiple. ¿Qué papel para la cladribina? ". Conocimientos de medicina clínica: Therapeutics:: 425. Doi:10.4137/CMT.S6456.
- ^ Leist TP, Weissert R (enero – febrero 2011). "La cladribina: modo de acción y las implicaciones para el tratamiento de la esclerosis múltiple.". Neurofarmacología clínica 34 (1): 28 – 35. Doi:10.1097/WNF.0b013e318204cd90. PMID21242742.
- ^ C Warnke, Wiendl H, Hartung HP, O Stüve, Kieseier BC (21 de julio de 2010). "Identificación de objetivos y nuevos desarrollos en el tratamiento de la esclerosis múltiple--foco en la cladribina.". La terapia, el desarrollo y diseño de fármacos 4:: 117 – 26. Doi:10.2147/DDDT.S6627. PMC2915536. PMID20689698.
- ^ Sigal DS, Miller HJ, ED Schram, Saven una (21 de octubre de 2010). "Más allá de células pilosas: la actividad de la cladribina en otras malignidades hematológicas." (PDF). Sangre 116 (16): 2884 – 96. Doi:10.1182/sangre-2010-02-246140. PMID20634380.
- ^ Sipe JC (marzo de 2010). "La cladribina tabletas: nuevo curso anual tratamiento potencial para la esclerosis múltiple.". De expertos de Neurotherapeutics 10 (3): 365 – 75. Doi:10.1586/ERN.10.12. PMID20187859.
- ^ Hartung HP, O Aktas, Kieseier B, Giancarlo Comi GC (febrero de 2010). "Desarrollo de cladribina oral para el tratamiento de la esclerosis múltiple". Revista de Neurología 257 (2): 163 – 70. Doi:10.1007/s00415-009-5359-0. PMID19921304.
- ^ C Warnke, VI Leussink, Goebels N, O Aktas, Boyko A, BC Kieseier, Hartung HP (enero de 2012). "Cladribina como opción terapéutica en la esclerosis múltiple". Inmunología Clínica (Orlando, Fla.) 142 (1): 68-75. Doi:10.1016/j.Clim.2011.05.009. PMID21733757.
- ^ C Warnke, Wiendl H, Hartung HP, O Stüve, Kieseier BC (21 de julio de 2010). "Identificación de objetivos y nuevos desarrollos en el tratamiento de la esclerosis múltiple--foco en la cladribina.". La terapia, el desarrollo y diseño de fármacos 4:: 117-126. Doi:10.2147/DDDT.S6627. PMC2915536. PMID20689698.
- ^ Bryson HM, Sorkin EM (noviembre de 1993). "La cladribina. Una revisión de sus propiedades farmacocinéticas y farmacodinámicas y potencial terapéutico en enfermedades hematológicas malignas. ". Drogas 46 (5): 872 – 894. Doi:10.2165/00003495-199346050-00007. PMID7507037.
- ^ Robak T, Korycka A, Robak E (enero de 2006). "Más viejas y nuevas formulaciones de cladribina. Farmacología y eficacia clínica en neoplasias hematológicas. ". Recientes patentes sobre el descubrimiento de fármacos contra el cáncer 1 (1): 23 – 38. Doi:10.2174/157489206775246467. PMID18221024.
- ^ Hentosh P, Peffley DM (junio de 2010). "El enigma de la cladribina: descifrar el mecanismo de la droga de la acción.". Dictamen pericial sobre el metabolismo de la droga y toxicología 6 (1): 75-81. Doi:10.1517/17425250903393745. PMID19968576.
- ^ C Warnke, VI Leussink, Goebels N, O Aktas, Boyko A, BC Kieseier, Hartung HP (enero de 2012). "La cladribina como opción terapéutica en la esclerosis múltiple". Inmunología Clínica 142 (1): 68-75. Doi:10.1016/j.Clim.2011.05.009. PMID21733757.
- ^ Kantarjian HM, S Jeha, Gandhi V, Wess M, Faderl S (octubre de 2007). "La clofarabina: pasado, presente y futuro.". Leucemia y linfoma 48 (10): 1922 – 30. Doi:10.1080/10428190701545644. PMID17852710.
- ^ Harned TM, Gaynon PS (abril de 2008). "Tratamiento de leucemias refractarias en la infancia, papel de clofarabina.". Gestión de riesgos clínicos y terapéutica 4 (2): 327 – 36. Doi:10.2147/TCRM.S2941. PMC2504075. PMID18728851.
- ^ Thomas X, Raffoux E, Elhamri M, lóbulo I, Cannas G, Dombret H (octubre de 2009). "Clofarabina para el tratamiento de la leucemia mieloide aguda en adultos". Futura Oncología (Londres, Inglaterra) 5 (8): 1197 – 210. Doi:10.2217/fon.09.105. PMID19852733.
- ^ Lech-Maranda E, Korycka A, Robak T (junio de 2009). "Como un análogo de nucleósido novela La clofarabina aprobado para tratar a pacientes con malignidades hematológicas: mecanismo de acción y actividad clínica.". Mini comentarios en química medicinal 9 (7): 805-812. Doi:10.2174/138955709788452586. PMID19519505.
- ^ Jeha S (octubre de 2009). "Avances recientes en el tratamiento de la leucemia linfoblástica aguda: clofarabina.". Clínicas de Hematología y Oncología de América del norte 23 (5): 1137 – 44, viii. Doi:10.1016/j.hoc.2009.07.011. PMID19825457.
- ^ Sampat K, Kantarjian H, Borthakur G (octubre de 2009). "La clofarabina: rol emergente en leucemias.". Dictamen pericial sobre drogas en investigación 18 (10): 1559-1564. Doi:10.1517/13543780903173222. PMID19715446.
- ^ Larson ML, Venugopal P (junio de 2009). "La clofarabina: una nueva opción de tratamiento para pacientes con leucemia mieloide aguda.". Dictamen pericial sobre farmacoterapia 10 (8): 1353 – 1357. Doi:10.1517/14656560902997990. PMID19463072.
- ^ Ghanem H, Jabbour E, Faderl S, V Ghandhi, Plunkett W, H Kantarjian (febrero de 2010). "Clofarabina en leucemia". De expertos de la hematología 3 (1): 15 – 22. Doi:10.1586/ehm.09.70. PMID21082931.
- ^ Ghanem H, H Kantarjian, M Ohanian, Jabbour E (abril de 2013). "El papel de clofarabina en leucemia mieloide aguda.". Leucemia y linfoma 54 (4): 688 – 698. Doi:10.3109/10428194.2012.726722. ISBN978-0-12-374340-4. PMID22957815.
- ^ Ghanem H, H Kantarjian, M Ohanian, Jabbour E (abril de 2013). "El papel de clofarabina en leucemia mieloide aguda". Leucemia y linfoma 54 (4): 688 – 698. Doi:10.3109/10428194.2012.726722. PMID22957815.
- ^ Hamada A, Kawaguchi T, Nakano M (2002). "Farmacocinética clínica de formulaciones de citarabina.". Farmacocinética clínica 41 (10): 705-718. Doi:10.2165/00003088-200241100-00002. PMID12162758.
- ^ Cros E, Jordheim L, C Dumontet, Galmarini CM (junio de 2004). "Problemas relacionados con la resistencia a la citarabina en leucemia mieloide aguda.". Leucemia y linfoma 45 (6): 1123-1132. Doi:10.1080/1042819032000159861. PMID15359991.
- ^ El‐Subbagh, HI; Al‐Badr, AA (2009). "Citarabina 2" (PDF). En Brittain, HG. Perfiles de fármacos y excipientes relacionados con metodología. Londres: académico. págs. 37 – 113. Doi:10.1016/S0099-5428 (08) 00002-6. ISBN978-0-12-374340-4. ISSN0099-5428.
- ^ "Dacogen (Decitabina) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 10 de febrero de 2014.
- ^ Bock, Gallati H, Zürcher RM, Bachofen M, Mihatsch MJ, Landmann J, Thiel G (enero de 2007). La decitabina y su papel en el tratamiento de Neoplasias hematopoyéticas. Leucemia y linfoma 48 (8): 1472 – 1481. Doi:10.1080/10428190701471981. PMID7701577.
- ^ OKI Y, Aoki E, Issa JP (febrero de 2007). "La decitabina — cabecera al banco". Reseñas críticas en Hematología/Oncología 61 (2): 140-152. Doi:10.1016/j.critrevonc.2006.07.010. PMID17023173.
- ^ Jabbour E, Issa JP, Garcia-Manero G, Kantarjian H (junio de 2008). "Evolución del desarrollo decitabina: logros, las investigaciones en curso y futuras estrategias." (PDF). Cáncer 112 (11): 2341 – 51. Doi:10.1002/CNCR.23463. PMID18398832.
- ^ Santos FP, H Kantarjian, Garcia-Manero G, Issa JP, Ravandi F (enero de 2010). "La decitabina en el tratamiento de los síndromes mielodisplásicos".. De expertos de la terapia contra el cáncer 10 (1): 9 – 22. Doi:10.1586/era.09.164. PMC2376088. PMID20014881.
- ^ Daskalakis M, N Blagitko-Dorfs, Hackanson B (2010). "La decitabina". Resultados recientes en la investigación del cáncer. Fortschritte der Krebsforschung. Les recherches sur le cáncer de progres dans 184:: 131 – 57. Doi:10.1007/978-3-642-01222-8_10. PMID20072836.
- ^ Marcas de PW (marzo de 2012). "La decitabina para la leucemia mieloide aguda.". De expertos de la terapia contra el cáncer 12 (3): 299-305. Doi:10.1586/era.11.207. PMID22369322.
- ^ Garcia JS, Jain N, Godley LA (junio de 2010). "Una actualización sobre la seguridad y eficacia de la decitabina en el tratamiento de los síndromes mielodisplásicos".. OncoTargets y terapia 3:: 1 – 13. Doi:10.2147/OTT.S7222. PMC2895778. PMID20616953.
- ^ Curran MP (12 de abril de 2013). "La decitabina: una revisión de su uso en pacientes de edad avanzada con leucemia mieloide aguda". Drogas y envejecimiento 30 (6): 447-458. Doi:10.1007/s40266-013-0084-x. PMID23580320.
- ^ "FUDR (floxiridina) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 10 de febrero de 2014.
- ^ Montillo M, F Ricci, Tedeschi (septiembre de 2006). "Papel de fludarabina en neoplasias hematológicas.". De expertos de la terapia contra el cáncer 6 (9): 1141 – 61. Doi:10.1586/14737140.6.9.1141. PMID17020450.
- ^ Anderson VR, Perry CM (2007). "La fludarabina: una revisión de su uso en el linfoma no hodgkiniano.". Drogas 67 (11): 1633 – 55. Doi:10.2165/00003495-200767110-00008. PMID17661532.
- ^ a b Ricci F, A, Tedeschi Morra E, Montillo M (febrero de 2009). "Fludarabina en el tratamiento de la leucemia linfocítica crónica: una revisión.". Gestión de riesgos clínicos y terapéutica 5 (1): 187-207. Doi:10.2147/TCRM.S3688. PMC2697528. PMID19436622.
- ^ Souchet-Compain L, S Nguyen, Choquet S, Leblond V (junio de 2013). "La fludarabina en la Waldenstrom macroglobulinemia de.". De expertos de la hematología 6 (3): 229-37. Doi:10.1586/ehm.13.17. PMID23782076.
- ^ Plosker GL, Figgitt DP (2003). "La fludarabina oral.". Drogas 63 (21): 2317 – 23. Doi:10.2165/00003495-200363210-00004. PMID14524733.
- ^ Lukenbill J, Kalaycio M (septiembre de 2013). "La fludarabina: una revisión de los riesgos y beneficios potenciales clara.". Investigación de la leucemia 37 (9): 986 – 94. Doi:10.1016/j.leukres.2013.05.004. PMID23787174.
- ^ GREM JL (noviembre de 2000). "5-fluorouracilo: más de 40 y sigue avanzando. Una revisión de su desarrollo preclínico y clínico. ". Nuevos fármacos en investigación 18 (4): 299 – 313. Doi:10.1023 / A:1006416410198. PMID11081567.
- ^ Abraham LM, Selva D, Casson R Leibovitch (2007). "Las aplicaciones clínicas de fluorouracilo en la práctica oftálmica.". Drogas 67 (2): 237-55. Doi:10.2165/00003495-200767020-00005. PMID17284086.
- ^ Patel PA (abril de 2011). "Evolución de quimiorradiación basada en 5-fluorouracilo en el tratamiento del cáncer rectal". Fármacos contra el cáncer 22 (4): 311 – 6. Doi:10.1097/CAD.0b013e3283441a63. PMID21301320.
- ^ Noble S, Goa KL (septiembre de 1997). "Gemcitabina. Una revisión de su farmacología y su potencial clínico en cáncer de pulmón de células no pequeñas y cáncer de páncreas. ". Drogas 54 (3): 447-472. Doi:10.2165/00003495-199754030-00009. PMID9279506.
- ^ AAPRO MS, Martín C, Hatty S (marzo de 1998). "Gemcitabine--una revisión de seguridad". Fármacos contra el cáncer 9 (3): 191-201. Doi:10.1097/00001813-199803000-00001. PMID9625429.
- ^ Ryan CW, Vogelzang NJ (marzo de 2000). "Gemcitabina en el tratamiento del cáncer de vejiga". Dictamen pericial sobre farmacoterapia 1 (3): 547-553. Doi:10.1517/14656566.1.3.547. PMID11249537.
- ^ Manegold C, P Zatloukal, Krejcy K, Blatter J (febrero de 2000). "Gemcitabina en cáncer de pulmón de células no pequeñas (CPCNP).". Nuevos fármacos en investigación 18 (1): 29-42. Doi:10.1023 / A:1006327729228. PMID10830139.
- ^ Oettle H, Arnold D, C Hempel, Riess H (noviembre de 2000). "El papel de la gemcitabina sola y en combinación en el tratamiento del cáncer de páncreas.". Fármacos contra el cáncer 11 (10): 771 – 86. Doi:10.1097/00001813-200011000-00001. PMID11142685.
- ^ Crinò L, Cappuzzo F (junio de 2002). "Gemcitabina en cáncer de pulmón de células no-pequeñas.". Dictamen pericial sobre farmacoterapia 3 (6): 745 – 753. Doi:10.1517/14656566.3.6.745. PMID12036414.
- ^ A Wong, tan RA, Yong WP, Innocenti F (2009). "Farmacología clínica y farmacogenética de gemcitabina. Comentarios sobre el metabolismo de la droga 41 (2): 77 – 88. Doi:10.1080/03602530902741828. PMID19514966.
- ^ Lennard L (octubre de 1992). "La farmacología clínica de la 6-mercaptopurina". European Journal of Clinical Pharmacology 43 (4): 329-339. Doi:10.1007/BF02220605. PMID1451710.
- ^ Bradford K, Shih DQ (07 de octubre de 2011). "Optimización de la 6-mercaptopurina y azatioprina terapia en el tratamiento de la enfermedad inflamatoria intestinal".. Revista Mundial de Gastroenterología 17 (37): 4166 – 73. Doi:10.3748/wjg.V17.i37.4166. PMC3208360. PMID22072847.
- ^ Timmer A, McDonald JWD, Tsoulis DJ, Macdonald JK (12 de septiembre de 2012). "La azatioprina y la 6-mercaptopurina para mantener la remisión en la colitis ulcerosa".. La base de datos Cochrane de revisiones sistemáticas 9:: CD000478. Doi:10.1002/14651858.CD000478.pub3. PMID22972046.
- ^ "Arranon (nelarabina) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 11 de febrero de 2014.
- ^ Reilly KM, Kisor DF (febrero de 2009). "El perfil de nelarabina: uso en el tratamiento de la leucemia linfoblástica aguda de células T.". OncoTargets y terapia 2:: 219 – 28. PMC2886323. PMID20616909.
- ^ DeAngelo DJ (octubre de 2009). "La nelarabina para el tratamiento de pacientes con recaída o refractaria t-célula leucemia linfoblástica aguda o linfoma linfoblástico.". Clínicas de Hematología y Oncología de América del norte 23 (5): 1121 – 35, vii-viii. Doi:10.1016/j.hoc.2009.07.008. PMID19825456.
- ^ Roecker AM, A, Stockert Kisor DF (diciembre de 2010). "En el tratamiento de Neoplasias de células T refractarios la nelarabina.". Conocimientos de medicina clínica. Oncología 4:: 133 – 41. Doi:10.4137/CMO.S4364. PMC2999959. PMID21151585.
- ^ Sanford M, Lyseng-Williamson KA (2008). "Nelarabina.". Drogas 68 (4): 439 – 47. Doi:10.2165/00003495-200868040-00004. PMID18318562.
- ^ Gandhi V, Plunkett W (noviembre de 2006). "La clofarabina y nelarabina: dos nuevos análogos de nucleósidos de purina.". Opinión actual en Oncología 18 (6): 584 – 90. Doi:10.1097/01.CCO.0000245326.65152.AF. PMID16988579.
- ^ Curbo S, Karlsson (septiembre de 2006). "Nelarabina: una nueva Purina análoga en el tratamiento de malignidades hematológicas.". Comentarios sobre ensayos clínicos recientes 1 (3): 185-92. Doi:10.2174/157488706778250104. PMID18473971.
- ^ Kline J, Larson RA (septiembre de 2006). "La nelarabina en el tratamiento de enfermedades malignas de células T refractarios.". Dictamen pericial sobre farmacoterapia 7 (13): 1791 – 9. Doi:10.1517/14656566.7.13.1791. PMID16925505.
- ^ Grever MR, Doan CA, Kraut EH (marzo de 2003). "Este medicamento en el tratamiento de la leucemia de células pilosas.". Mejor práctica e investigación. Hematología clínica 16 (1): 91 – 9. Doi:10.1016/S1521-6926 (03) 00002-1. PMID12670468.
- ^ M Higman, GB Vogelsang, Chen (diciembre de 2004). Pentostatina – farmacología, Inmunología y los efectos clínicos en injerto - versus - host disease. Dictamen pericial sobre farmacoterapia 5 (12): 2605-2613. Doi:10.1517/14656566.5.12.2605. PMID15571477.
- ^ Ho AD, Hensel M (abril de 2006). "Este medicamento para el tratamiento de Trastornos Linfoproliferativos indolente.". Seminarios en hematología 43 (2 Suppl 2): S2 – 10. Doi:10.1053/j.seminhematol.2005.12.005. PMID16549110.
- ^ Grever MR (octubre de 2006). "La pentostatina: impacto sobre el resultado en leucemia de células pilosas". Clínicas de Hematología y Oncología de América del norte 20 (5): 1099 – 1108. Doi:10.1016/j.hoc.2006.06.001. PMID16990110.
- ^ Sauter C, N Lamanna, Weiss MA (septiembre de 2008). "Este medicamento en la leucemia linfocítica crónica.". Dictamen pericial sobre el metabolismo de la droga y toxicología 4 (9): 1217 – 22. Doi:10.1517/17425255.4.9.1217. PMID18721115.
- ^ N Lamanna, Kay NE (junio de 2009). "Este medicamento tratamiento combinaciones en la leucemia linfocítica crónica.". Avances clínicos en hematología y Oncología 7 (6): 386-392. PMID19606074.
- ^ Wellington K, Goa KL (2001). "Oral tegafur/uracilo.". Drogas y envejecimiento 18 (12): 935-48; discusión 949 – 50. Doi:10.2165/00002512-200118120-00005. PMID11888348.
- ^ Takiuchi H, Ajani JA (agosto de 1998). "Tegafur-uracilo en carcinoma gástrico: una revisión exhaustiva.". Journal of Clinical Oncology 16 (8): 2877 – 85. PMID9704742.
- ^ Ward SE, E Kaltenthaler, Cowan J, Marples M, B Orr, Seymour MT (03 de julio de 2006). "Los beneficios clínicos y económicos de capecitabina y tegafur con uracil en cáncer colorrectal metastásico". Revista británica de cáncer 95 (1): 27 – 34. Doi:10.1038/sj.BJC.6603215. PMC2360498. PMID16804526.
- ^ Casado E, Pfeiffer P, Feliu J, González-Barón M, Vestermark L, Jensen hectáreas (agosto de 2008). "UFT (tegafur-uracilo) en el cáncer rectal.". Anales de Oncología 19 (8): 1371 – 8. Doi:10.1093/annonc/mdn067. PMID18381370.
- ^ T Ishikawa (14 de mayo de 2008). "La quimioterapia con recubrimiento entérico tegafur/uracilo para el carcinoma hepatocelular avanzado".. Revista Mundial de Gastroenterología 14 (18): 2797 – 801. Doi:10.3748/wjg.14.2797. PMC2710718. PMID18473401.
- ^ Oba K (abril de 2009). "Eficacia de la quimioterapia adyuvante con régimen de tegafur-basado para curativo resecado cáncer gástrico: actualización de un metanálisis.". Revista Internacional de oncología clínica 14 (2): 85 – 9. Doi:10.1007/s10147-009-0877-4. PMID19390937.
- ^ Matt P, van Zwieten-Boot B, Calvo Rojas G, Ter Hofstede H, R García-Carbonero, Camarero J, E Abadie, Pignatti F (2011). "La revisión de la Agencia Europea de medicamentos de Tegafur/Gimeracil/Oteracil (Teysuno ™) para el tratamiento del cáncer gástrico avanzado cuando se administra en combinación con cisplatino: Resumen de la evaluación científica del Comité de medicamentos de uso humano (CHMP).". El oncólogo 16 (10): 1451 – 7. Doi:10.1634/theoncologist.2011-0224. PMC3228070. PMID21963999.
- ^ Estlin EJ (diciembre de 2001). "Continuando con la terapia para la leucemia linfoblástica aguda infantil: Farmacología clínica y celular del metotrexato, la 6-mercaptopurina y la 6-tioguanina.". Comentarios sobre el tratamiento del cáncer 27 (6): 351 – 63. Doi:10.1053/CTRV.2002.0245. PMID11908928.
- ^ Elgemeie GH (2003). "Este medicamento, mercaptopurina: sus análogos y nucleósidos como antimetabolitos.". Diseño farmacéutica actual 9 (31): 2627 – 42. Doi:10.2174/1381612033453677. PMID14529546.
- ^ Duley JA, Florin TH (octubre de 2005). "Terapias tiopurina: problemas y complejidades progreso con monitoreo tioguanina nucleótidos.". Análisis farmacológico 27 (5): 647 – 654. Doi:10.1097/01.FTD.0000169061.52715.3e. PMID16175140.
- ^ De Bruyne R, B Portmann, Samyn M, S Bansal, Alcantara A, G Mieli-Vergani, Dhawan (febrero de 2006). "Enfermedad del higado crónica relacionada con 6-tioguanina en niños con leucemia linfoblástica aguda.". Diario de Hepatología 44 (2): 407 – 10. Doi:10.1016/j.jhep.2005.06.020. PMID16226335.
- ^ Seinen ML, van Asseldonk DP, Mulder CJ, de Boer NK (septiembre de 2010). "Dosificación 6-tioguanina en enfermedad inflamatoria intestinal: experto basado en directrices para la práctica diaria." (PDF). Revista de enfermedades gastrointestinales y hepáticas 19 (3): 291 – 4. PMID20922194.
- ^ Tung JP, HI Maibach (noviembre de 1990). "El uso práctico del metotrexato en psoriasis.". Drogas 40 (5): 697 – 712. Doi:10.2165/00003495-199040050-00005. PMID2292232.
- ^ Bannwarth B, Labat L, Moride Y, Schaeverbeke T (enero de 1994). "El metotrexato en la artritis reumatoide. Una actualización. ". Drogas 47 (1): 25 – 50. Doi:10.2165/00003495-199447010-00003. PMID7510620.
- ^ Barnhart K, Coutifaris C, Esposito M (marzo de 2001). "La farmacología del metotrexato.". Dictamen pericial sobre farmacoterapia 2 (3): 409 – 17. Doi:10.1517/14656566.2.3.409. PMID11336595.
- ^ Khan ZA, R Tripathi, Mishra B (febrero de 2012). "Metotrexato: una revisión detallada sobre la administración de fármacos y aspectos clínicos.". Dictamen pericial sobre la entrega de la droga 9 (2): 151 – 69. Doi:10.1517/17425247.2012.642362. PMID22251428.
- ^ Graber JJ, Omuro un (01 de junio de 2011). "Farmacoterapia para linfoma primario del CNS: progreso más allá de metotrexato?". Drogas del SNC 25 (6): 447 – 57. Doi:10.2165/11589030-000000000-00000. PMID21649446.
- ^ Dogra S, R Mahajan (agosto de 2013). "Terapia de metotrexato sistémico para la psoriasis: pasado, presente y futuro". Dermatología clínica y Experimental 38 (6): 573-588. Doi:10.1111/CED.12062. PMID23837932.
- ^ Curtin NJ, Hughes un (mayo de 2001). "Pemetrexed disódico, una novela antifolate con múltiples objetivos.". La revista Lancet Oncology 2 (5): 298-306. Doi:10.1016/S1470-2045 (00) 00325-9. PMID11905785.
- ^ Gatzemeier U (noviembre de 2004). "Pemetrexed en mesotelioma pleural maligno". Oncología (Williston Park, N.Y.) 18 (8 de 13 Suppl): 26 – 31. PMID15655933.
- ^ Sobrero A, Caprioni F, Fornarini G, S Mammoliti, Comandini D, Baldo S, Decian F (noviembre de 2004). "Pemetrexed en el cáncer gástrico". Oncología (Williston Park, N.Y.) 18 (8 de 13 Suppl): 51 – 5. PMID15655938.
- ^ M Hazarika, RM blanco, cabina BP, Wang YC, jamón DY, Liang CY, Rahman A, Gobburu JV, Li N, Sridhara R, Morse DE, Lostritto R, Garvey P, Johnson JR., Pazdur R (01 de febrero de 2005). "El Pemetrexed en mesotelioma pleural maligno". (PDF). Investigación clínica de cáncer: un diario oficial de la American Association for Cancer Research 11 (3): 982 – 92. PMID15709163.
- ^ Puto K, Garey JS (abril de 2005). "Terapia Pemetrexed para el mesotelioma pleural maligno.". Los anales de la farmacoterapia 39 (4): 678 – 83. Doi:10.1345/APH.1E329. PMID15755794.
- ^ Villela LR, Stanford BL, Shah SR (mayo de 2006). "Pemetrexed, una novedosa alternativa terapéutica antifolatos para quimioterapia contra el cáncer". Farmacoterapia 26 (5): 641 – 54. Doi:10.1592/phco.26.5.641. PMID16637794.
- ^ Goeminne H, van Meerbeeck JP (mayo de 2006). "El Pemetrexed en cáncer torácico.". Dictamen pericial sobre farmacoterapia 7 (7): 917 – 28. Doi:10.1517/14656566.7.7.917. PMID16634714.
- ^ C Monnerat, Le Chevalier T (mayo de 2006). "Revisión de la combinación de pemetrexed y gemcitabina en pacientes con cáncer de pulmón de células no pequeñas avanzado". (PDF). Anales de la Oncología: diario oficial de la European Society for Medical Oncology / ESMO. 17 Suppl 5: v86 – 90. Doi:10.1093/annonc/mdj958. PMID16807472.
- ^ Longo-Sorbello GS, Chen B, Budak-Alpdogan T, Bertino JR (febrero de 2007). "Papel de pemetrexed en cáncer de pulmón de células no pequeñas". Investigación del cáncer 25 (1): 59-66. Doi:10.1080/07357900601130748. PMID17364559.
- ^ S Chattopadhyay, Moran RG, Goldman ID (febrero de 2007). "El Pemetrexed: Farmacología bioquímica y celular, mecanismos y aplicaciones clínicas". Molecular oncológica 6 (2): 404 – 417. Doi:10.1158/1535-7163.MCT-06-0343. PMID17308042.
- ^ Di Biasi B, Caliolo C, Meriggi F, Zaniboni (diciembre de 2007). "El papel potencial de pemetrexed en cáncer gastrointestinal". Quimioterapia 54 (1): 1 – 8. Doi:10.1159/000112311. PMID18063861.
- ^ a b Kulkarni PM, Chen R, Anand T, Monberg MJ, Obasaju CK (julio de 2008). "Eficacia y seguridad de pemetrexed en pacientes con cáncer ancianos: resultados de un análisis integrado.". Reseñas críticas en Hematología/Oncología 67 (1): 64 – 70. Doi:10.1016/j.critrevonc.2008.01.011. PMID18358737.
- ^ Felip E, Rosell R (junio de 2008). "Pemetrexed como terapia de segunda línea para el cáncer de pulmón no microcítico avanzado (NSCLC).". Gestión de riesgos clínicos y terapéutica 4 (3): 579 – 85. Doi:10.2147/TCRM.S2248. PMC2500250. PMID18827853.
- ^ Hsu JY, Wakelee H (septiembre de 2008). "El Pemetrexed disódico para el tratamiento del cáncer: una actualización.". Las drogas de hoy (Barcelona, España: 1998) 44 (9): 669 – 78. Doi:10.1358/dot.2008.44.9.1250412. PMID19137122.
- ^ Peake, MD (julio de 2009). "Pemetrexed en el tratamiento del mesotelioma pleural maligno". Terapia 6 (4): 569-575. Doi:10.2217/Thy.09.30.
- ^ Manegold C, Schmid-Bindert G, Pilz LR (septiembre de 2009). "Pemetrexed para el tratamiento del cáncer de pulmón de células no pequeñas". De expertos de la terapia contra el cáncer 9 (9): 1195 – 209. Doi:10.1586/ERA.09.97. PMID19761423.
- ^ Tomao F, PB Panici, Frati L, Tomao S (diciembre de 2009). "Rol emergente de pemetrexed en cáncer de ovario.". De expertos de la terapia contra el cáncer 9 (12): 1727 – 35. Doi:10.1586/ERA.09.141. PMID19954283.
- ^ Fleeman N, Bagust A, C McLeod, J Greenhalgh, Boland A, Dundar Y, Dickson R, Tudur Smith C, Davis H, verde J, Pearson M (mayo de 2010). "El Pemetrexed para el tratamiento de primera línea de cáncer de pulmón de células no pequeñas localmente avanzado o metastásico.". Avaluació de tecnologia (Winchester, Inglaterra). 14 Suppl 1: 47: 53. Doi:10.3310/hta14Suppl1/07. PMID20507803.
- ^ Fuld AD, Dragnev KH, Rigas JR (junio de 2010). "El Pemetrexed en cáncer de pulmón no microcítico avanzado.". Dictamen pericial sobre farmacoterapia 11 (8): 1387 – 402. Doi:10.1517/14656566.2010.482560. PMID20446853.
- ^ Somer, R (abril de 2010). "Terapia de mantenimiento para el cáncer metastásico de pulmón no microcítico – el papel del pemetrexed" (PDF). Cáncer de pulmón: Objetivos y terapia 1:: 1 – 7. Doi:10.2147/LCTT.S7105.
- ^ Greenhalgh J, McLeod C, Bagust A, Boland A, N Fleeman, Dundar Y, Oyee J, Dickson R, Davis H, J verde, E McKenna, Pearson M (octubre de 2010). "El Pemetrexed para el tratamiento de cáncer de pulmón de células no pequeñas localmente avanzado o metastásico mantenimiento.". Avaluació de tecnologia (Winchester, Inglaterra) 14 (Suppl 2): 33 – 39. Doi:10.3310/hta14suppl2/05. PMID21047489.
- ^ Gridelli C, P Maione, Rossi A, Bareschino MA, Schettino C, Sacco PC, Zeppa R (marzo de 2011). "Pemetrexed en cáncer de pulmón de células no pequeñas avanzado". Dictamen pericial sobre seguridad de medicamentos 10 (2): 311 – 7. Doi:10.1517/14740338.2011.553281. PMID21261558.
- ^ Morotti M, Valenzano Menada M, PL Venturini, Mammoliti S, Ferrero S (abril de 2012). "El Pemetrexed disódico en tratamiento de cáncer de ovario.". Dictamen pericial sobre drogas en investigación 21 (4): 437 – 49. Doi:10.1517/13543784.2012.661714. PMID22324304.
- ^ Argiris A Pennella E, Koustenis A, Hossain AM, Obasaju CK (junio de 2013). "Pemetrexed en cáncer de cabeza y cuello: una revisión sistemática.". Oncología Bucal 49 (6): 492-501. Doi:10.1016/j.oraloncology.2013.01.007. PMID23466170.
- ^ Mercedes CC, VAN Tulder MW, hamburguesas JA, Beckeringh JJ, Wagner C, Hugtenburg JG (septiembre de 2013). "El valor de pemetrexed para el tratamiento del mesotelioma pleural maligno: una revisión exhaustiva.". Investigación contra el cáncer 33 (9): 3553 – 61. PMID24023280.
- ^ Gunasekara NS, Faulds D (marzo de 1998). "III. Una revisión de sus propiedades farmacológicas y la eficacia clínica en el manejo de avanzado cáncer colorrectal. ". Drogas 55 (3): 423 – 35. Doi:10.2165/00003495-199855030-00012. PMID9530547.
- ^ Clarke SJ, Beale PJ, Rivory LP (diciembre de 2000). "Clínica y preclínica farmacocinética de raltitrexed.". Farmacocinética clínica 39 (6): 429 – 443. Doi:10.1517/13543784.7.5.823. PMID11192475.
- ^ a b Caponigro F, Avallone A, Budillon A, P Comella, Comella G (julio de 2001). "III/5-fluorouracilo-combinado basado en los regímenes de quimioterapia en la terapia anticancerígena.". Fármacos contra el cáncer 12 (6): 489 – 97. Doi:10.1097/00001813-200107000-00001. PMID11459994.
- ^ Cunningham D, J Zalcberg, Maroun J, James R, Clarke S, Maughan TS, Vincent M, Schulz J, González Barón M, Facchini T (marzo de 2002). "Eficacia, tolerabilidad y gestión de raltitrexed (Tomudex ™) monoterapia en pacientes con cáncer colorrectal avanzado". European Journal of Cancer 38 (4): 478 – 486. Doi:10.1016/S0959-8049 (01) 00413-0. PMID11872339.
- ^ Van Cutsem E, Cunningham D, Maroun J, Cervantes A, Glimelius B (01 de abril de 2002). "III: estado clínico actual y futuro". Anales de Oncología 13 (4): 513-522. Doi:10.1093/annonc/mdf054. PMID12056700.
- ^ Cao S, A, Bhattacharya Durrani FA, Fakih M (abril de 2006). "El Irinotecan, el oxaliplatino e III para el tratamiento del cáncer colorrectal avanzado.". Dictamen pericial sobre farmacoterapia 7 (6): 687 – 703. Doi:10.1517/14656566.7.6.687. PMID16556086.
- ^ Wilson KS, Malfair Taylor SC (noviembre de 2009). "III: optimismo y la realidad.". Dictamen pericial sobre el metabolismo de la droga y toxicología 5 (11): 1447-1454. Doi:10.1517/17425250903307455. PMID19863453.
- ^ Mulaku M, Opiyo N, Karumbi J, Kitonyi G, Thoithi G, español M (noviembre de 2013). "Pruebas revisión de hidroxiurea para la prevención de complicaciones de células falciformes en países de bajos ingresos".. Archivos de la enfermedad en la infancia 98 (11): 908 – 14. Doi:10.1136/archdischild-2012-302387. PMC3812872. PMID23995076.
- ^ Navarra P, Preziosi P (febrero de 1999). "Hidroxiurea: nuevas perspectivas en una vieja droga.". Reseñas críticas en Hematología/Oncología 29 (3): 249-55. Doi:10.1016/S1040-8428 (98) 00032-8. PMID10226728.
- ^ Romanelli c., Pomeroy, Smith KM (febrero de 1999). "Hidroxiurea para inhibir la replicación del virus de inmunodeficiencia humana-1". Farmacoterapia 19 (2): 196-204. Doi:10.1592/phco.19.3.196.30913. PMID10030769.
- ^ Vichinsky EP (julio de 1997). "Hidroxiurea en niños: presente y futuro.". Seminarios en hematología 34 (3 Suppl 3): 22 – 9. PMID9317198.
- ^ Gwilt PR, Tracewell WG (mayo de 1998). "Farmacocinética y farmacodinámica de hidroxiurea. Farmacocinética clínica 34 (5): 347-358. Doi:10.2165/00003088-199834050-00002. PMID9592619.
- ^ Ravot E, Lisziewicz J, Lori F (1999). "Nuevos usos de viejas drogas en la infección por VIH". Drogas 58 (6): 953 – 963. Doi:10.2165/00003495-199958060-00001. PMID10651384.
- ^ Hidroxiurea (PDF) 76. 2000.
- ^ Banan M (marzo de 2013). "Tratamiento del Hydroxyurea en pacientes de β-talasemia: para responder o no responder?". Anales de la hematología 92 (3): 289 – 99. Doi:10.1007/s00277-012-1671-3. PMID23318979.
- ^ Dingli D, Tefferi (junio de 2006). "Hidroxiurea: el fármaco de elección para la policitemia vera y la trombocitopenia esencial.". Informes actuales de malignidad hematológica 1 (2): 69-74. Doi:10.1007/s11899-006-0025-4. PMID20425334.
- ^ Lisziewicz J, A, Foli Wainberg M Lori F (2003). "Hidroxiurea en el tratamiento de la infección por VIH: preocupación de eficacia y seguridad clínica.". Seguridad de las 26 (9): 605 – 24. Doi:10.2165/00002018-200326090-00002. PMID12814330.
- ^ a b c d e f g h i Bhatia, S (2008). "Malignidades secundarias: relacionada con el tratamiento t-MDS/AML". Medscape Reference. WebMD. 07 de febrero de 2014.
- ^ Shimada M, Itamochi H, Kigawa J (mayo de 2013). "Nedaplatin: un derivado de cisplatino en quimioterapia contra el cáncer.". Investigación y manejo del cáncer 5:: 67-76. Doi:10.2147/CMAR.S35785. PMC3658440. PMID23696716.
- ^ Ravandi F, Estey EH, Appelbaum FR, Lo-Coco F, Schiffer CA, Larson RA, Burnett AK, Kantarjian HM (17 de septiembre de 2012). "Gemtuzumab ozogamicina: tiempo para resucitar?" (PDF). Journal of Clinical Oncology 30 (32): 3921 – 3923. Doi:10.1200/JCO.2012.43.0132. PMID22987091.
- ^ Lehnert M, Ludwig H, Zojer N (febrero de 2009). "Actualización en el uso racional de Y-ibritumomab tiuxetan en el tratamiento del linfoma folicular.". OncoTargets y terapia 2:: 199-208. Doi:10.2147/Ott.s3975. PMC2886339. PMID20616907.
- ^ Cheson BD (2005). "El papel de radioinmunoterapia con itrio-90 ibritumomab tiuxetan en el tratamiento del linfoma no hodgkiniano.". BioDrugs: clínica immunotherapeutics, biofarmacéuticos y gene terapia 19 (5): 309 – 22. Doi:10.2165/00063030-200519050-00004. PMID16207072.
- ^ C Nabhan, Kay NE (marzo de 2011). "El papel emergente de ofatumumab en el tratamiento de la leucemia linfocítica crónica".. Conocimientos de medicina clínica. Oncología 5:: 45 – 53. Doi:10.4137/CMO.S4087. PMC3076040. PMID21499555.
- ^ Osterborg (marzo de 2010). "Ofatumumab, un anticuerpo monoclonal anti-CD20 humana.". Opinión de experto en terapia biológica 10 (3): 439 – 49. Doi:10.1517/14712590903586239. PMID20109133.
- ^ Sanford M, McCormack PL (mayo de 2010). "Ofatumumab". Drogas 70 (8): 1013-1019. Doi:10.2165/11203850-000000000-00000. PMID20481657.
- ^ Davies AJ (28 de mayo de 2007). "La radioinmunoterapia para linfoma de células B: Y90 ibritumomab tiuxetan y tositumomab I131". Oncogén 26 (25): 3614-3628. Doi:10.1038/sj.ONC.1210378. PMID17530015.
- ^ "Bexxar (tositumomab) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ "Gilotrif (afatinib)". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ "Zaltrap (ziv-aflibercept) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ Escudier B, Gore M (2011). "Axitinib para el tratamiento del carcinoma metastásico de células renales".. Drogas en R & D 11 (2): 113 – 26. Doi:10.2165/11591240-000000000-00000. PMC3585900. PMID21679004.
- ^ "Bosulif (bosutinib) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ Amsberg GK, Koschmieder S (marzo de 2013). "Perfil de bosutinib y su potencial clínico en el tratamiento de la leucemia mieloide crónica". OncoTargets y terapia 6:: 99-106. Doi:10.2147/OTT.S19901. PMC3594007. PMID23493838.
- ^ "Xalkori (crizotinib) de dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ Forde PM, Rudin CM (junio de 2012). "Crizotinib en el tratamiento del cáncer de pulmón de células no pequeñas". Dictamen pericial sobre farmacoterapia 13 (8): 1195 – 201. Doi:10.1517/14656566.2012.688029. PMID22594847.
- ^ Frampton JE (28 de noviembre de 2013). "Crizotinib: una revisión de su uso en el tratamiento del linfoma anaplástico de la cinasa-positivo, avanzado cáncer de pulmón de células no pequeñas". Drogas 73 (18): 2031-2051. Doi:10.1007/s40265-013-0142-z. PMID24288180.
- ^ Rothschild, SI; Gautschi, O (septiembre de 2013). "Crizotinib en el tratamiento del cáncer de pulmón de células no – pequeñas". Cáncer de pulmón clínico 14 (5): 473-480. Doi:10.1016/j.CLLC.2013.04.006.
- ^ Roskoski R (septiembre de 2013). "El perfil preclínico del crizotinib para el tratamiento del cáncer de pulmón no microcítico y otros Trastornos neoplásicos". Dictamen pericial sobre el descubrimiento de fármacos 8 (9): 1165 – 1179. Doi:10.1517/17460441.2013.813015. PMID23805942.
- ^ "Iclusig (ponatinib) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ Precio KE, Saleem N, Lee G, Steinberg M (agosto de 2013). "Potencial de ponatinib para tratar la leucemia mieloide crónica y la leucemia linfoblástica aguda".. OncoTargets y terapia 6:: 1111 – 8. Doi:10.2147/OTT.S36980. PMC3754816. PMID23986642.
- ^ "Stivarga (regorafenib) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ Strumberg d., Schultheis B (junio de 2012) "Regorafenib para el cáncer". Dictamen pericial sobre drogas en investigación 21 (6): 879 – 889. Doi:10.1517/13543784.2012.684752. PMID22577890.
- ^ Aprile G, Macerelli M, Giuliani F (23 de febrero de 2013). "Regorafenib para las malignidades gastrointestinales". BioDrugs 27 (3): 213-224. Doi:10.1007/s40259-013-0014-9. PMID23435872.
- ^ Shahda S, Saif MW (mayo de 2013). "Regorafenib: desde Banco de cabecera en el cáncer colorrectal". De expertos de la farmacología clínica 6 (3): 243-248. Doi:10.1586/ECP.13.11. PMID23656338.
- ^ "Jakafi (ruxolitinib) de dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 10 de febrero de 2014.
- ^ "JAKAVI ® Ruxolitinib" (PDF). Servicios eBusiness TGA. Novartis Pharmaceuticals Australia Pty Limited. 21 de enero de 2014.
- ^ Kantarjian HM, plata RT, Komrokji RS, Mesa RA, Tacke R, Harrison CN (diciembre de 2013). "Ruxolitinib para Mielofibrosis – una actualización de sus efectos clínicos" (PDF). La leucemia y el linfoma clínica mieloma 13 (6): 638 – 645. Doi:10.1016/j.Clove mi life.2013.09.006. PMID24238036.
- ^ Vaddi K, Sarlis NJ, Gupta V (noviembre de 2012). "Ruxolitinib, un inhibidor oral de JAK1 y JAK2, en mielofibrosis". Dictamen pericial sobre farmacoterapia 13 (16): 2397 – 2407. Doi:10.1517/14656566.2012.732998. PMID23051187.
- ^ "El Vandetanib dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ "Targretin (bexaroteno) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ Matthay KK (03 de diciembre de 2012). "Objetivo Isotretinoin en Neuroblastoma: cinética, genética o absorción". Clinical Cancer Research 19 (2): 311-313. Doi:10.1158/1078-0432.CCR-12-3313. PMID23209029.
- ^ "Amnesteem, Claravis (isotretinoína) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ "Cápsulas de 20mg de isotretinoína - Resumen de las características del producto (SPC)". Compendio de medicamentos de electrónica. Alianza farmacéutica. 12 de abril de 2013. 09 de febrero de 2014.
- ^ Miwako I, Kagechika H (agosto de 2007). "Tamibarotene.". Las drogas de hoy (Barcelona, España: 1998) 43 (8): 563 – 8. Doi:10.1358/dot.2007.43.8.1072615. PMID17925887.
- ^ Fukasawa H, Nakagomi M, N de Yamagata, Katsuki H, K Kawahara, Kitaoka K, Miki T, Shudo K (2012). "Tamibarotene: una droga de retinoide candidato para la enfermedad de Alzheimer.". Boletín biológica y farmacéutica 35 (8): 1206 – 12. Doi:10.1248/bpb.B12-00314. PMID22863914.
- ^ Takeuchi M (marzo de 2006). "[Experiencia clínica con un nuevo retinoide sintético, tamibarotene (Am-80) para la leucemia promielocítica aguda refractaria o recidivante].". Gan a kagaku ryoho. El cáncer y la quimioterapia (en japonés) 33 (3): 397-401. PMID16531727.
- ^ "Istodax (romidepsina) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 10 de febrero de 2014.
- ^ Bellos F, Mahlknecht U (noviembre de 2008). "Valproico ácido y ácido all-trans-retinoico: meta-análisis de un régimen de tratamiento paliativo en pacientes con AML y MDS.". Onkologie 31 (11): 629 – 33. Doi:10.1159/000160599. PMID19145098.
- ^ Blaheta RA, Nau H, Michaelis M, Cinatl J (agosto de 2002). "Valproato y valproato-análogos: potentes herramientas para luchar contra el cáncer.". Química medicinal actual 9 (15): 1417 – 33. Doi:10.2174/0929867023369763. PMID12173980.
- ^ Blaheta RA, Cinatl J (septiembre de 2002). "Los mecanismos antitumorales del valproato: un papel nuevo para una vieja droga.". Comentarios sobre investigación medicinal 22 (5): 492 – 511. Doi:10.1002/med.10017. PMID12210556.
- ^ Duenas-Gonzalez A, Candelaria M, Perez-Plascencia C, Pérez-Cárdenas E, de la Cruz-Hernández E, Herrera LA (mayo de 2008). "El ácido valproico como droga de Epigenética del cáncer: efectos preclínicos, clínicos y transcripcionales en tumores sólidos.". Comentarios sobre el tratamiento del cáncer 34 (3): 206 – 22. Doi:10.1016/j.CTRV.2007.11.003. PMID18226465.
- ^ "Zolinza (vorinostat) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 10 de febrero de 2014.
- ^ "Ontak (denileucina) dosificación, indicaciones, interacciones, efectos adversos y más". Medscape Reference. WebMD. 09 de febrero de 2014.
- ^ Lansigan F, Stearns DM, Foss F (febrero de 2010). "Papel de la denileucina diftitox en el tratamiento del linfoma de células T cutáneo persistente o recurrente". Investigación y manejo del cáncer 2:: 53 – 59. Doi:10.2147/CMAR.S5009. PMC3004568. PMID21188096.
- ^ Manoukian G, Hagemeister F (noviembre de 2009). "La denileucina diftitox: una inmunotoxina novela". Opinión de experto en terapia biológica 9 (11): 1445 – 1451. Doi:10.1517/14712590903348135. PMID19817678.
- ^ Kamintzky d., Hymes KB (diciembre de 2008) "La denileucina diftitox para el tratamiento del linfoma cutáneo de células T". Productos biológicos: Objetivos y terapia 2 (4): 717-724. Doi:10.2147/BTT.S3084. PMC2727893. PMID19707452.
Bibliografía
- Rachel Airley (2009). Quimioterapia para el cáncer. Wiley-Blackwell. ISBN0-470-09254-8.
- Madera, Miriam; David Brighton (2005). El manual del Royal Marsden Hospital de quimioterapia contra el cáncer: una guía para el equipo multidisciplinario. St. Louis, Mo: Elsevier Churchill Livingstone. ISBN0-443-07101-2.
- Fergus Macbeth; Hanna, Louise; Crosby, Tom (2008). Oncología clínica práctica. Cambridge, UK: Cambridge University Press.
- Perry, Michael J. (2008). El libro fuente de quimioterapia. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins.
- Faguet, tipo B. (2005). La guerra contra el cáncer. Springer. p. 71. ISBN1-4020-3618-3.
- Hirsch J (septiembre de 2006). "Un aniversario para quimioterapia contra el cáncer". JAMA 296 (12): 1518 – 20. Doi:10.1001/Jama.296.12.1518. PMID17003400.
- Huang, Elbert S. (2000). Medicina interna: manual para los clínicos, guía de supervivencia residente. Arlington, VA: Scrub Hill Press. p. 130. ISBN978-0-9645467-5-2.
- Randall, [editado por] William J. Hoskins, Carlos A. Perez, Robert C. Young, Richard R. Barakat, Maurie Markman, Marcus E. (2005). Principios y práctica de oncología ginecológica (4. ed.). Baltimore, MD.: Lippincott Williams & Wilkins. págs. 93-94. ISBN0781746892.
Enlaces externos
- Búsqueda de ensayos de quimioterapia
- Sociedad Americana del cáncer - la quimioterapia
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||