Reacción en cadena de polimerasa en tiempo real


A reacción en cadena de polimerasa en tiempo real es un técnica de laboratorio de biología molecular basado en la reacción en cadena de polimerasa (PCR), que se utiliza para amplificar y simultáneamente detectar o cuantificar un objetivo DNA molécula.
El procedimiento sigue el principio general de la reacción en cadena de polimerasa; su característica fundamental es que el ADN amplificado se detecta mientras que progresa la reacción en "tiempo real". Este es un nuevo enfoque frente a la PCR estándar, donde el producto de la reacción se detecta en su extremo. Dos métodos comunes para la detección de productos de PCR cuantitativa son: inespecífica (1) tintes fluorescentes que intercalar cualquier ADN de doble hebra, y (2) secuencia-específica Sondas de ADN que consiste en oligonucleótidos que están etiquetados con un fluorescente reportero que permite la detección sólo después hibridación de la sonda con su secuencia complementaria para cuantificar ARN mensajero (ARNm) y RNA no codificante en células o tejidos.
La información mínima de las directrices de publicación de cuantitativa en tiempo real PCR experimentos (MIQE) proponen que la abreviatura qPCR utilizarse para la PCR cuantitativa en tiempo real y utilizar RT-qPCR para qPCR – transcripción inversa [1]. El acrónimo "RT-PCR" denota comúnmente reacción en cadena de polimerasa de transcripción inversa y PCR en tiempo real no, pero no todos los autores adhieren a este Convenio.[1]
Contenido
- 1 Fondo
- 2 Principios básicos
- 3 Clasificación
- 3.1 PCR cuantitativa con tintes de ADN de doble hebra como reporteros
- 3.2 Método de sonda fluorescente reportera
- 4 Análisis de la temperatura de fusión
- 4.1 Cuantificación de la expresión génica
- 4.2 Modelado
- 5 Aplicaciones
- 5.1 Usos de diagnósticos
- 5.2 Usos microbiológicos
- 5.3 Usos en la investigación
- 5.4 Detección de fitopatógenos
- 5.5 Detección de organismos genéticamente modificados
- 5.6 Genotipificación y cuantificación clínica
- 6 Referencias
- 7 Bibliografía
- 8 Enlaces externos
Fondo
Las células en todos los organismos regulan expresión del gen por facturación de genes transcritos (ARN mensajero, abreviado a mRNA): La cantidad de un gen expresado en una célula puede medirse por el número de copias de una transcripción de mRNA de ese gen presente en una muestra. Para robusta detectar y cuantificar la expresión génica de pequeñas cantidades de RNA, la amplificación de la transcripción del gene es necesaria. El reacción en cadena de polimerasa (PCR) es un método común para amplificar la DNA; para PCR mRNA basado en la muestra de RNA es primero inversa-transcrito a ADN complementario (cDNA) con de la transcriptasa reversa.
Con el fin de amplificar pequeñas cantidades de ADN, se utiliza la misma metodología como en PCR convencional utilizando una plantilla de ADN, por lo menos un par de específicos cartillas de, desoxirribonucleótidos, un adecuado solución tampón y un termo-estable Polimerasa de la DNA. Una sustancia marcada con un fluoróforo se añade a esta mezcla en un termociclador contiene sensores de para la medición de la fluorescencia de la flurophore después de que ha sido excitado en el longitud de onda permitiendo que la tasa de generación al medirse por uno o más productos específicos. Esto permite que la tasa de generación del producto amplificado se mide en cada PCR ciclo. Los datos así generados pueden ser analizados por el software de computadora para calcular expresión génica relativa (o número de copias de mRNA) en varias muestras. PCR cuantitativa puede aplicarse también a la detección y cuantificación de DNA en muestras para determinar la presencia y abundancia de una determinada secuencia de ADN en estas muestras.[2] Esta medición se realiza después de cada ciclo de amplificación, y esta es la razón por qué este método es llamado PCR en tiempo real (es decir, PCR inmediata o simultánea). En el caso de cuantificación de RNA, la plantilla es ADN complementario (cDNA), que se obtiene por transcripción reversa de ácido ribonucleico (ARN). En este caso la técnica utilizada es RT-PCR cuantitativa o RT-Q-PCR.
PCR cuantitativa y Microarrays de ADN son metodologías modernas para el estudio de expresión del gen. Los métodos antiguos se utilizaron para medir la abundancia de ARNm: Despliegue diferencial, Ensayo de protección de Rnasa y Mancha blanca /negra norteña. El borrar norteño a menudo se utiliza para estimar el nivel de expresión de un gen por visualizar la abundancia de la transcripción de mRNA en una muestra. En este método, el RNA purificado se separa por electroforesis en gel de agarosa, transferido a una matriz sólida (como una membrana de nylon) y probó con un específico Sonda de ADN o ARN Es decir complementarias para el gen de interés. Aunque esta técnica todavía se utiliza para evaluar la expresión génica, requiere cantidades relativamente grandes de ARN y proporciona sólo cualitativa o semi información cuantitativa de los niveles de mRNA.[3] Errores de estimación derivadas de variaciones en el método de cuantificación pueden ser el resultado de la integridad del ADN, eficiencia de la enzima y muchos otros factores. Por esta razón un número de normalización sistemas han sido desarrollados. Algunos han sido desarrollados para cuantificar la expresión génica total, pero los más comunes están dirigidas a cuantificar el gen específico que están estudiando en relación con otro gen denominado un gen normalización, que se selecciona para su nivel de expresión casi constante. Estos genes son a menudo seleccionados de Housekeeping genes como sus funciones relacionadas con la básica celular supervivencia normalmente tienen expresión del gen constitutivo.[4][5] Esto permite a los investigadores informar una proporción para la expresión de los genes de interés dividido por la expresión de la normalizador seleccionado, permitiendo la comparación de los anteriores sin conocer realmente su nivel absoluto de la expresión.
Los genes de normalización más comúnmente utilizados son los que codifican para las moléculas siguientes: tubulina, gliceraldehído-3-fosfato deshidrogenasa, albúmina, ciclofilina, y ARN ribosómico.[3]
Principios básicos
PCR cuantitativa se lleva a cabo en un termociclador con la capacidad de iluminar cada muestra con un haz de luz de longitud de onda especificada y detectar la fluorescencia emitida por el emocionado fluoróforo. El termociclador es capaz de rápidamente muestras de calor y frío, así aprovechando las propiedades fisicoquímicas de la ácidos nucleicos y Polimerasa de la DNA.
El proceso PCR generalmente consta de una serie de cambios de temperatura que se repiten 25 – 50 veces. Estos ciclos consisten normalmente en tres etapas: la primera, alrededor de 95 ° c, permite la separación de la doble cadena de ácido nucleico; el segundo, a una temperatura de alrededor de 50-60 ° C, permite a la Unión de los cebadores con la plantilla de la DNA;[6] la tercera, a entre 68 y 72 ° C, facilita la polimerización llevado a cabo por la ADN polimerasa. Debido al pequeño tamaño de los fragmentos del último paso se omite generalmente en este tipo de PCR como la enzima es capaz de aumentar su número durante el cambio entre la etapa de alineación y la etapa de desnaturalización. Además, algunos ciclistas térmicas añadir otra fase de temperatura corta, durando sólo unos segundos para cada ciclo, con una temperatura de, por ejemplo, 80 ° C, con el fin de reducir el ruido causado por la presencia de dímeros de primer cuando un tinte no específico se utiliza. Las temperaturas y los tiempos utilizados en cada ciclo dependen de una amplia variedad de parámetros, tales como: la enzima usada para sintetizar el ADN, la concentración de iones divalentes y desoxirribonucleótidos (dNTPs) en la reacción y la temperatura de unión de los cebadores.[7]
Clasificación
El tipo de técnica cuantitativa de PCR utilizado depende de la secuencia del ADN en las muestras, la técnica puede usar fluorocromos no específicos o sondas de hibridación.
PCR cuantitativa con tintes de ADN de doble hebra como reporteros
Un tinte de unión a DNA se une a todos bicatenario (ds) DNA en PCR, causando la fluorescencia del tinte. Un aumento en producto de la DNA durante PCR por lo tanto conduce a un aumento en la intensidad de la fluorescencia y se mide en cada ciclo, permitiendo así que las concentraciones de DNA a ser cuantificada. Sin embargo, dsDNA tales como colorantes SYBR Green se unirá a todos los productos PCR de dsDNA, incluidos los productos PCR inespecíficos (tales como Dímeros de primer). Potencialmente puede interferir con, o evitar, la cuantificación precisa de la secuencia objetivo. El SYBR Green es excitado mediante luz azul (λmáximo = 488 nm) y emite luz verde (λmáximo = 522 nm).[8]
- La reacción se prepara como de costumbre, con la adición de colorante fluorescente dsDNA.
- La reacción se ejecuta en un instrumento PCR cuantitativa, y después de cada ciclo, los niveles de fluorescencia se mide con un detector; el tinte aparece sólo cuando obligado a dsDNA (es decir, el producto de la polimerización en cadena). Con referencia a la dilución estándar, puede determinarse la concentración de dsDNA en el PCR.
Este método tiene la ventaja de necesitar sólo un par de cartillas para llevar a cabo la amplificación, que mantiene los costos sin embargo, sólo es posible amplificar un producto usando una reacción en cadena.
Como otros métodos cuantitativos de PCR, los valores obtenidos no tienen unidades absolutas asociadas a ellos (es decir, mRNA copias/célula). Como se describió anteriormente, una comparación de una muestra de ADN/ARN medida a una dilusión estándar dará solamente una fracción o proporción de la muestra en relación con el estándar, permitiendo comparaciones sólo relativas entre diferentes tejidos o condiciones experimentales. Para asegurar la precisión en la cuantificación, es generalmente necesario normalizar la expresión de un gene de la blanco a un gene expresado estable (véase abajo). Esto puede corregir las posibles diferencias de calidad o cantidad de RNA en muestras experimentales.
Método de sonda fluorescente reportera
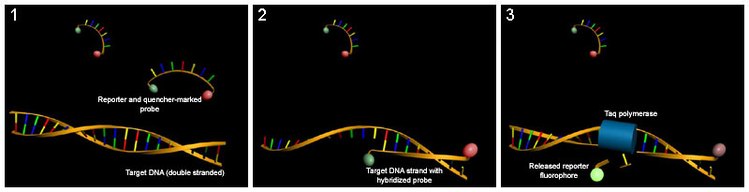
Fluorescente puntas de prueba del reportero detectan sólo el ADN que contiene la secuencia de la sonda; por lo tanto, uso de la sonda de reportero significativamente aumenta la especificidad y permite la cuantificación incluso en presencia de la amplificación de la DNA no específico. Sondas fluorescentes pueden ser utilizadas en ensayos multiplex, para la detección de varios genes en la misma reacción, basadas en sondas específicas con etiquetas de diferentes colores, siempre que todos los genes específicos se amplifican con similar eficacia. La especificidad de las sondas fluorescentes reportero también evita la interferencia de las mediciones causadas por dímeros de primer, que son subproductos potenciales indeseables en PCR. Sin embargo, las puntas de prueba fluorescentes reportero no impiden el efecto inhibitorio de los dímeros de cartilla, que puede apretar la acumulación de los productos deseados en la reacción.
El método se basa en un sondeo basado en el ADN con un reportero fluorescente en un extremo y un Quencher de fluorescencia en el extremo opuesto de la sonda. La proximidad del reportero el extintor previene la detección de su fluorescencia; avería de la sonda por la 5' a 3' exonucleasa actividad de la Taq polimerasa rompe la proximidad reportero quencher y permite así la insaciable emisión de fluorescencia, que puede ser detectada después de excitación con un láser. Un aumento en el producto blanco de la punta de prueba del reportero en cada ciclo PCR por lo tanto causa un aumento proporcional en la fluorescencia debido a la avería de la sonda y la liberación de la periodista.
- La PCR está preparada como de costumbre (véase POLIMERIZACIÓN EN CADENA), y se añade la punta de prueba del reportero.
- Como la reacción comienza, durante la de recocido etapa de la polimerización en cadena tanto probe y cebadores hibridan en el destino del ADN.
- Polimerización de una nueva hebra de ADN se inicia desde los iniciadores, y una vez que la polimerasa llega a la punta de prueba, su 5'-3'-exonucleasa degrada la sonda, el reportero fluorescente físicamente separa el quencher, resultando en un incremento en la fluorescencia.
- La fluorescencia se detecta y se mide en una máquina PCR en tiempo real, y su aumento geométrico correspondiente aumento exponencial del producto se utiliza para determinar el ciclo de cuantificación (Cq) en cada reacción.
Análisis de la temperatura de fusión

Q-PCR permite la identificación de fragmentos de ADN específicas, amplificados mediante el análisis de sus temperatura de fusión (también llamado Tm valor de mElting temperatura). El método utilizado es la PCR generalmente con tintes de ADN de doble hebra como reporteros y el tinte utilizado es generalmente SYBR Green. El ADN temperatura de fusión es específico para el fragmento amplificado. Los resultados de esta técnica se obtienen comparando las curvas de disociación de las muestras de DNA analizadas.[10]
A diferencia de la PCR convencional, este método evita el uso previo de electroforesis técnicas para demostrar los resultados de las muestras. Esto es porque, a pesar de ser una técnica cinética, PCR cuantitativa es generalmente evaluada en un punto final distinto. La técnica por lo tanto generalmente proporciona resultados más rápidos y / o utiliza menos reactivos de electroforesis. Si se requiere el posterior electroforesis sólo es necesario probar las muestras tiempo real que PCR ha demostrado ser dudosa o ratificar los resultados de las muestras que han sido positivas para un determinante específico.
Cuantificación de la expresión génica
Cuantificación de la expresión génica mediante los métodos tradicionales de detección de ADN no es confiable. Detección de mRNA en un Mancha blanca /negra norteña o productos PCR en una gel o Mancha blanca /negra meridional no permite la cuantificación precisa.[11] Por ejemplo, sobre los 20-40 ciclos de una PCR típica, la cantidad de ADN producto alcanza un Meseta de no se correlaciona directamente con la cantidad de ADN en la PCR inicial Diana.[citación necesitada]
PCR cuantitativa permite cuantificar ácidos nucleicos dos métodos comunes: cuantificación relativa y cuantificación absoluta.[12] Cuantificación absoluta da el número exacto de moléculas de ADN diana en comparación con estándares de ADN usando un curva de calibración. Por lo tanto, es esencial que la PCR de la muestra y el estándar tienen el mismo eficiencia de amplificación. Cuantificación relativa se basa en genes de referencia interna para determinar fold-diferencias en la expresión del gen objetivo. La cuantificación se expresa como el cambio en los niveles de expresión de mRNA interpretado como ADN complementario (cDNA, generado por transcripción reversa de ARNm). Cuantificación relativa es más fácil de realizar ya que no requiere una curva de calibración la cantidad del gen estudiado es comparada con la cantidad de un gen de control limpieza.
Que las unidades utilizadas para expresar los resultados de cuantificación relativa importancia pueden compararse los resultados a través de un número de diferente RT-Q-PCR. La razón para usar uno o más genes housekeeping es corregir la variación no específicos, tales como las diferencias en la cantidad y calidad del ARN utilizada, que puede afectar la eficiencia de la transcripción inversa y por lo tanto, que de todo el proceso de polimerización en cadena. Sin embargo, el aspecto más crucial del proceso es que el gen de referencia debe ser estable.[13]
La selección de estos genes de referencia realizada tradicionalmente en biología molecular mediante estudios cualitativos o semi-cuantitativos como el examen visual de los geles de RNA, Northern blot Densitometría ósea o PCR semicuantitativa (imitadores de la polimerización en cadena). Ahora, en el genoma época, es posible realizar una estimación más detallada para muchos organismos con Microarrays de DNA.[14] Sin embargo, investigaciones han demostrado que la amplificación de la mayoría de los genes de referencia utilizados en la cuantificación de la expresión de mRNA varía según las condiciones experimentales.[15][16][17] Por lo tanto, es necesario llevar a cabo un primer estadísticamente sonido estudio metodológico con el fin de seleccionar el gen de referencia más adecuado.
Han desarrollado una serie de algoritmos estadísticos que pueden detectar qué gen o genes son los más adecuados para el uso bajo condiciones dadas. Como geNORM o BestKeeper pueden comparar pares o medio geométrico para una matriz de genes de referencia diferentes y tejidos.[18][19]
Modelado
A diferencia de final punto de PCR (PCR convencional) en tiempo real PCR permite la cuantificación del producto deseado en cualquier punto en el proceso de amplificación mediante la medición de la fluorescencia (en realidad, medición se hace de su nivel sobre un determinado umbral). Un método comúnmente empleado de cuantificación de ADN por PCR cuantitativa se basa en trazar la fluorescencia contra el número de ciclos en un escala logarítmica. Un umbral para la detección de fluorescencia basada en ADN se encuentra ligeramente por encima del fondo. El número de ciclos en el que la fluorescencia supera el umbral se denomina el ciclo umbral (Ct) o, según las directrices MIQE, cuantificación del ciclo (Cq).[20]
Durante la fase exponencial de amplificación, la cantidad de la plantilla de ADN diana (amplicon) duplica cada ciclo. Por ejemplo, un ADN muestra que Cq precede que de otra muestra por 3 ciclos Figura 23 = plantilla 8 veces más. Sin embargo, la eficiencia de amplificación es a menudo variable entre iniciadores y plantillas. Por lo tanto, se evalúa la eficacia de una combinación de cartilla-plantilla en un titulación experimentar con diluciones seriadas de la plantilla de la DNA para crear un curva estándar del cambio en la Cq con cada dilución. El pendiente de la regresión lineal se utiliza para determinar la eficiencia de amplificación, que es 100% si una dilución de 1:2 se traduce en un Cq diferencia de 1. El método de umbral de ciclo hace varias hipótesis de mecanismo de reacción y tiene una dependencia de datos de regiones bajas de señal a ruido del perfil de amplificación que puede presentar variación sustancial durante el análisis de datos.[21]
Para cuantificar la expresión génica, la Cq para un ARN o del ADN del gen de interés se resta de la Cq de ARN/ADN de un gen de la limpieza en la misma muestra para normalizar para la variación en la cantidad y calidad del ARN entre diferentes muestras. Este procedimiento de normalización se llama comúnmente la ΔCt-método de[22] y comparación de permisos de la expresión de un gen de interés entre diferentes muestras. Sin embargo, para tal comparación, expresión del gen de referencia normalización debe ser muy similar en todas las muestras. Elección de un gen de referencia cumpliendo este criterio es, por tanto, de gran importancia y a menudo desafiante, porque solamente muy pocos genes muestran iguales niveles de expresión a través de una gama de diversas condiciones o tejidos.[23][24] Aunque análisis de umbral de ciclo está integrado con muchos sistemas de software comercial, existen métodos más precisos y confiables de análisis de los datos de Perfil de amplificación que deben considerarse en casos donde está una preocupación la reproducibilidad.[21]
Métodos de cuantificación de qPCR basado en mecanismos también se han sugerido y tienen la ventaja que no requieren una curva estándar para la cuantificación. Métodos como MAK2[25] se ha demostrado que tienen un rendimiento igual o mejor cuantitativo métodos de curva estándar. Estos métodos basados en el mecanismo de usan de conocimiento sobre el proceso de amplificación de la polimerasa para generar las estimaciones de la concentración de la muestra original. Una extensión de este enfoque incluye un modelo exacto del todo Perfil de reacción de PCR, que permite el uso de datos con alta relación señal a ruido y la capacidad de validar la calidad de los datos antes del análisis.[21]
Aplicaciones
Hay numerosas aplicaciones para la reacción en cadena de la polimerasa cuantitativo en el laboratorio. Se utiliza comúnmente para ambos diagnóstico y investigación básica. Aplicaciones de la técnica en la industria incluyen la cuantificación de la carga microbiana en los alimentos o materia vegetal, la detección de OGMs (Organismos genéticamente modificados) y la cuantificación y genotipado de patógenos virales humanos.
Usos de diagnósticos
Diagnóstico PCR cuantitativa se aplica para detectar rápidamente ácidos nucleicos son diagnóstico de, por ejemplo, enfermedades infecciosas, cáncer y anormalidades genéticas. Análisis de la introducción de la PCR cuantitativa para el laboratorio de microbiología clínica ha mejorado significativamente el diagnóstico de enfermedades infecciosas,[26] y se despliega como una herramienta para detectar enfermedades nuevas, como nuevas cepas de contra la gripe, en pruebas de diagnóstico.[27]
Usos microbiológicos
PCR cuantitativa también es utilizado por microbiólogos que trabajan en los campos de la fermentación, deterioro de los alimentos y seguridad alimentaria y para la evaluación del riesgo microbiano de la calidad del agua (aguas de beber y recreativas) y en la protección de la salud pública.[28]
El ensayo antibacteriano Recuento de colonias virtuales[29] utiliza una técnica de cuantificación de datos llamada cuantitativos crecimiento cinética (QGK) que es matemáticamente idéntico a QPCR, excepto las células bacterianas, en lugar de copias de un producto de la PCR, aumentan exponencialmente. El equivalente QGK del ciclo umbral se conoce como el "tiempo de umbral".
Usos en la investigación
En contextos de investigación, la PCR cuantitativa se utiliza principalmente para proporcionar medidas cuantitativas de transcripción genética. La tecnología puede utilizarse en la determinación de cómo la expresión génica de un gen en particular cambia con el tiempo, como en la respuesta de cultivos de tejidos y células a una administración de un farmacológicas agente, progresión de la diferenciación celular, o en respuesta a cambios en las condiciones ambientales. También se utiliza para la determinación del zygosity de los animales transgénicos utilizados en la investigación.
Detección de fitopatógenos
La industria agrícola se esmera constantemente producir propágulos de plantas o plántulas libres de patógenos con el fin de evitar pérdidas económicas y proteger la salud. Se han desarrollado sistemas que permiten la detección de pequeñas cantidades de ADN de Phytophthora ramorum, un oomiceto que mata Robles y otras especies, mezcladas con el ADN de la planta huésped. Discriminación entre el ADN del patógeno y la planta se basa en la amplificación de sus secuencias, espaciadores situados en ARN ribosómico gen que codifica el área, que son característicos para cada taxón.[30] Versiones basadas en el campo de esta técnica también se han desarrollado para identificar el patógeno mismo.[31]
Detección de organismos genéticamente modificados
qPCR con transcripción inversa (RT-qPCR) puede ser utilizado para detectar Organismos modificados genéticamente dada su sensibilidad y rango dinámico en la detección de ADN. Alternativas como los análisis de ADN o proteínas son generalmente menos sensibles. Iniciadores específicos que amplifican no el transgén se utilizan, pero la promotor, Terminator o incluso secuencias durante el proceso de ingeniería del vector. Como el proceso de creación de una planta transgénica normalmente conduce a la inserción de más de una copia del transgen también comúnmente se evalúa su cantidad. Esto es a menudo realizada por cuantificación relativa utilizando un gen de control de las especies tratadas que sólo está presentes como una sola copia.[32][33]
Genotipificación y cuantificación clínica
Virus pueden estar presentes en los seres humanos debido a la infección directa o coinfección. Esto hace que diagnóstico difícil utilizar técnicas clásicas y puede resultar en una incorrecta pronóstico y el tratamiento. El uso de qPCR permite la cuantificación y genotipado (caracterización de la cepa, llevó a cabo mediante curvas de fusión) de un virus como el Virus de la hepatitis B.[34] El grado de infección, cuantificado como las copias del genoma viral por unidad de tejido del paciente, es relevante en muchos casos; por ejemplo, la probabilidad de que el tipo 1 virus del herpes simple reactiva se relaciona con el número de infectados neuronas En ganglios.[35] Esta cuantificación se lleva a cabo con transcripción inversa o sin ella, como ocurre si el virus se integra en el genoma humano en algún momento de su ciclo, tal como sucede en el caso de HPV (virus del papiloma humano), donde algunas de sus variantes se asocian con la aparición de cáncer de cuello uterino.[36]
Referencias
- ^ editado por Julie Logan, Kirstin Edwards y Nick Saunders. (2009). Saunders N, Logan J, Edwards K, ed. PCR en tiempo real: Tecnología actual y aplicaciones. Prensa académica de Caister. ISBN978-1-904455-39-4.
- ^ J. D. Watson; Baker, T. a.; Campana, S. P.; Gann, A.; Levine, M. et Losick, R (2004). Biología molecular del gen (Quinta Ed.). San Francisco: Benjamin Cummings. ISBN0-321-22368-3.
- ^ a b Michael W. Pfaff, Tichopad Ales, Christian Prgomet y Tanja P. Neuvians (2005). Determinación de genes housekeeping estable, diferencialmente regulados blanco genes y la integridad de la muestra: BestKeeper – herramienta basada en Excel utilizando correlaciones pares Letras de biotecnología 26:: 509-515
- ^ Pfaffl, MW; Horgan, GW; Dempfle, L (2002). "Herramienta de expresión relativa (resto ©) para grupo sabia comparación y análisis estadístico de los resultados de la expresión relativa de PCR en tiempo real". Nucl. Ácidos Res. 30:: e36.
- ^ Vandesompele, J; De Preter, K; Pattyn, F; Poppe, B; Van Roy, N; De Paepe, A; Speleman, F (2002). "Normalización precisa de datos de RT-PCR cuantitativos en tiempo real por el promedio geométrico de múltiples genes de control interno". Biol Gén. 3:: 1 – 12.
- ^ W Rychlik, Spencer WJ, Rhoads RE (1990). "Optimización de la temperatura de recocido para la amplificación de ADN en vitro". Res de ácidos Nucl 18 (21): 6409-6412. doi:10.1093/Nar/18.21.6409. PMC332522. PMID2243783.
- ^ José Sambrook y David W. Russel (2001). Clonación molecular: Un Manual de laboratorio (3ª Ed.). Cold Spring Harbor, N.Y.: Prensa de laboratorio Cold Spring Harbor. ISBN0-87969-576-5.
- ^ Cremallera et al (2004). "Investigaciones en la intercalación de ADN y la superficie de unión de SYBR Green I, su determinación estructural y consecuencias metodológicas". Ácidos nucleic Res 32 (12): e103. doi:10.1093/Nar/gnh101. PMC484200. PMID15249599.
- ^ F Ponchel, Toomes C, K de Bransfield, Leong F.T, Douglas S.H, campo S.L, Bell Puisieux S.M, Combaret V, A, Mighell A.J (2003). "PCR en tiempo real basado en SYBR-Green de la fluorescencia: una alternativa para el ensayo TaqMan para una cuantificación relativa de los cambios de gene, amplificaciones de genes y canceladuras del gene micro" (W).. Biotechnol BMC 3:: 18. doi:10.1186/1472-6750-3-18.
- ^ Ririe K.M, Rasmussen R.P, Wittwer C.T. (1997). "Diferenciación del producto por el análisis de las curvas de fusión durante la reacción en cadena de polimerasa de la DNA" (PDF). Bioquímica analítica 245 (2): 154 – 160. doi:10.1006/abio.1996.9916. PMID9056205.
- ^ Bruce Gelerter. «CEMP para el tratamiento de trastornos de la córneos».
- ^ S. Dhanasekaran, T. Mark Doherty, John Kenneth y grupo de estudio de ensayos TB. (Mar de 2010). "Comparación de diversos estándares para la cuantificación absoluta basada en PCR en tiempo real". Métodos de Immunol. 354 (1-2): 34 – 9. doi:10.1016/j.Jim.2010.01.004. PMID20109462.
- ^ Brunner, AM; Yakovlev, IA; Strauss, SH (2004). "Validación de controles internos para estudios de expresión génica planta cuantitativa". BMC planta Biol 4:: 14.
- ^ Czechowski, T; Stitt, M; Altmann, T; Udvardi, MK; Scheible, WR (2005). "Genoma identificación y pruebas de los genes de referencia superior de normalización de la transcripción en Arabidopsis". Planta Physiol 139:: 5 – 17. doi:10.1104/PP.105.063743.
- ^ Thellin, O; Zorzi, W; Lakaye, B; De Borman, B; Coumans, B; Henne, G; Grisar, T; Igout, A; Heinen, E (1999). "Genes housekeeping como estándares internos: uso y límites". J Biotechnol 75:: 197-200.
- ^ Radonic, A; Thulke, S; Mackay, IM; Landt, O; Siegert, W; Nitsche, (2004). "Guía para la selección de genes de referencia para PCR cuantitativa en tiempo real". Bioquímica Biophys Res Commun 313:: 856-862. doi:10.1016/j.bbrc.2003.11.177.
- ^ Dheda, K; Hernández, JF; Reventar, SA; Johnson, MA; Torre, G; Zumla, (2004). "Validación de genes housekeeping para normalizar la expresión de RNA en PCR en tiempo real". Biotechniques 37:: 112-119.
- ^ Vandesompele J, De Preter K, Pattyn F, B Poppe, Van Roy N, De Paepe A, normalización precisa Speleman F (2002) de datos de RT-PCR cuantitativos en tiempo real por un promedio geométrico de múltiples interna control de genes" Biol del genoma 37: RESEARCH0034
- ^ Pfaffl, MW; Tichopad, A; PRGOMET, C; Neuvians, TP (2004). "Determinación de genes housekeeping estable, diferencialmente regulados blanco genes y la integridad de la muestra: BestKeeper, herramienta basada en Excel utilizando correlaciones pares". Biotechnol Lett 26:: 509-515. doi:10.1023/b:Bile.0000019559.84305.47.
- ^ Stephen A. reventar, Vladimir Benes, Jeremy A. Garson, Jan Hellemans, Jim Huggett, Mikael Kubista, Reinhold Mueller, Tania Nolan, Michael W. Pfaffl, Gregory L. Shipley, Jo Vandesompele y Carl T. Wittwer. (Abr de 2009). "Las directrices MIQE: información mínima para la publicación de los experimentos PCR cuantitativa en tiempo real". Clin Chem. 55 (4):: 611 – 22. doi:10.1373/clinchem.2008.112797. PMID19246619.
- ^ a b c Carr, A. C.; Moore, S. D. (2012). Lucia, Alejandro, ed. "Robusta cuantificación de reacciones en cadena de polimerasa usando conexión Global". PLoS uno 7 (5): e37640. doi:10.1371/journal.pone.0037640. PMC3365123. PMID22701526.
- ^ Schefe JH, Lehmann KE, Buschmann IR, Unger T, Kaiser Funke H (2006). «Análisis de datos de RT-PCR en tiempo real cuantitativo: conceptos actuales y la novela "diferencia de CT de la expresión génica «fórmula». J Mol Med 84 (11): 901 – 10. doi:10.1007/s00109-006-0097-6. PMID16972087.
- ^ Nailis H, Coenye T, Van Nieuwerburgh F, Deforce D, Nelis HJ (2006). "Desarrollo y evaluación de las estrategias de normalización diferentes para estudios de expresión génica en Candida albicans biofilms por PCR en tiempo real". BMC Mol Biol 7 (1): 25. doi:10.1186/1471-2199-7-25. PMC1557526. PMID16889665.
- ^ T de Nolan, las manos RE, Bustin SA (2006). "Cuantificación del mRNA usando RT-PCR en tiempo real". Protoc nacional. 1 (3): 1559 – 1582. doi:10.1038/nprot.2006.236. PMID17406449.
- ^ G pantanoso, Woolf PJ (2010). Ravasi, Timoteo, ed. "Un modelo mecanicista de PCR para la cuantificación precisa de los datos de la PCR cuantitativa". PLOS One 5 (8): e12355. doi:10.1371/journal.pone.0012355. PMC2930010. PMID20814578.
- ^ Velas AD (2009). "Aplicaciones en microbiología clínica". PCR en tiempo real: Tecnología actual y aplicaciones. Prensa académica de Caister. ISBN978-1-904455-39-4.
- ^ FDA autoriza uso de emergencia de la gripe medicamentos, prueba de diagnóstico en respuesta al brote de gripe porcina en seres humanos. FDA News, 27 de abril de 2009.
- ^ Filion, m. (editor) (2012). PCR cuantitativa a tiempo real en Microbiología aplicada. Prensa académica de Caister. ISBN978-1-908230-01-0.
- ^ B Ericksen, Wu Z, Lu W, Lehrer RI. (2005). "Actividad antibacteriana y la especificidad de las α-defensinas humanas seis". Antimicrob Agentes Chemother. 49 (1): 269-75. doi:10.1128/AAC.49.1.269-275.2005. PMC538877. PMID15616305.
- ^ Baldwin, B.G. (1992). "Utilidad phylogenetic de interno transcrito espaciadores de ADN ribosomal nuclear en plantas: un ejemplo de la Compositaogy". Evolución y filogenia molecular 1 (1): 3 – 16. doi:10.1016/1055-7903 (92) 90030-K. PMID1342921.
- ^ Tomlinson, j. A.; Barker, I.; Boonham, N. (2007). "Más rápido, más sencillo, métodos más específicos para mejorar Molecular detección de Phytophthora ramorum en el campo". Microbiología aplicada y ambiental 73 (12): 4040-4047. doi:10.1128/AEM.00161-07. PMC1932743. PMID17449689.
- ^ A Holst-jensen, rea R {o} estribor, vseth L {o} A, Berdal K.G. (2003). "Tecnología PCR para la detección y cuantificación de organismos modificados genéticamente (OMG)" (PDF). Analítica y química bioanalítica 375 (8): 985-993. doi:10.1007/s00216-003-1767-7.
- ^ Brodmann P.D, Ilg C.E, Berthoud H, A. Herrmann (2002). "... Tiempo métodos de reacción en cadena de la polimerasa cuantitativa para cuatro modificación genéticamente variedades de maíz...". Diario del AOAC internacional 85 (3): 646-653. doi:10.5555/jaoi.2002.85.3.646. PMID12083257.
- ^ Yeh S.H. Tsai CY Kao J.H. Liu C.J. Kuo T.J. Lin M.W. Huang W.L. Lu S.F. Jih J. Chen D.S. Otros (2004). "Cuantificación y genotipado del virus de la hepatitis B en una sola reacción de PCR en tiempo real y la fusión...". Diario de Hepatología 41 (4): 659-666. doi:10.1016/j.jhep.2004.06.031. PMID15464248.
- ^ N.M. de Moscow (1998). "La probabilidad de que en Vivo la reactivación del Herpes Simplex Virus tipo 1 aumenta con el número de neuronas infectadas latente en los ganglios". Diario de la virología 72 (8): 6888-6892. PMC109900. PMID9658140.
- ^ Peter M. Rosty C. Couturier J. Radvanyi F. Teshima H. Sastre-garau x. (2006). "Activación de MYC asociada con la integración de DNA de HPV en el locus MYC en los tumores genitales" (W).. Oncogén 25 (44): 5985-5993. doi:10.1038/sj.ONC.1209625. PMID16682952.
Bibliografía
- Elyse; Houde, Alain (2002). "En la PCR temps réel: principes et aplicaciones" (PDF). Comentarios en biología y biotecnología 2 (2): 2 – 11.
- Reventar, SA (2000). "cuantificación absoluta del mRNA usando en tiempo real inversa ensayos de reacción en cadena de polimerasa de transcripción". J Mol Endocrinol 25 (2): 169 – 93. doi:10.1677/JME.0.0250169. PMID11013345.
- Higuchi, R.; Dollinger, G.; Walsh, P.S.; Griffith, R. (1992). "Detección de secuencias específicas de ADN y amplificación simultánea". Bio-tecnología 10 (4): 413-417. doi:10.1038/nbt0492-413.
- Holanda, P.M.; Abramson, R.D.; Watson, r.; Gelfand, D.H. (1991). "Detección del producto de la reacción en cadena de polimerasa específica utilizando los 50! 30 actividad exonucleasa de aquaticus de Thermus polimerasa de la DNA". E.e.u.u. el proc. nacional Acad. SCI. 88 (16): 7276-7280. JSTOR2357665.
- Kubista, M; Andrade, JM; Bengtsson, M; Forootan, A; Jonak, J; Lind, K; Sindelka, R; Sjoback, R; Sjogreen, B; Strombom, L; Stahlberg, A; Zoric, N (2006). "La reacción en cadena de polimerasa en tiempo real". Aspectos de mol Med. 27 (2-3): 95 – 125. doi:10.1016/j.MAM.2005.12.007. PMID16460794.
- Higuchi, R.; Fockler, C.; Dollinger, G.; Watson, R. (1993). "PCR cinético: monitoreo en tiempo Real de las reacciones de amplificación de ADN". Biotecnología 11:: 1026-1030. doi:10.1038/nbt0993-1026.
- Filion, M. (2012). "PCR cuantitativa a tiempo real en Microbiología aplicada". Prensa académica de Caister. ISBN 978-1-908230-01-0
- Wawrik, B; Paul, JH; Tabita, Franco (2002). "Cuantificación de PCR en tiempo real de rbcL (ribulosa-1, 5-bifosfato carboxilasa/oxigenasa) mRNA en diatomeas y pelagophytes ". Environ LIQ. Latinoamericana de investigación pediátrica 68:: 3771, 3779. doi:10.1128/AEM.68.8.3771-3779.2002.
- Logan J, Edwards K, Saunders N (editores) (2009). PCR en tiempo real: Tecnología actual y aplicaciones. Prensa académica de Caister. ISBN978-1-904455-39-4.
Enlaces externos
- Guía de principiantes para tiempo Real PCR por Primerdesign
- La referencia en la Q-PCR académico & Industrial plataforma de información
- Tutorial PCR tiempo real por Dr. Margaret Hunt, Universidad de Carolina del sur, 05 de septiembre de 2006
- openwetware
- RefGenes Abra la herramienta de acceso para identificar genes de referencia específica de tejido para RT-qPCR
- Experiencias de usuario de Realtime PCR
- Artículos sobre Pcr tiempo Real
- Conceptos básicos sobre qPCR
|
||||||
Otras Páginas
- X-parametros
- Reflejo de Moro
- Ampolla (medicina)
- Hoplocrepis
- Telefono publico (redireccion desde telefono publico)
- Estacion de tren de Kouvola
- William Bucknell
- La Queue du Marsupilami
- Diccionario de SNIA
- CloudVisit telemedicina
- John McCain (seccion primero dos terminos en Senado de Estados Unidos)
- Puerto seguro (comercio)
- Medicina etnoveterinaria