Técnica aire-libre
Técnicas de aire libre se refieren a una amplia gama de manipulaciones en la química laboratorio para el manejo de compuestos son aire-sensible. Estas técnicas de impiden que los compuestos reaccionan con los componentes de aire, generalmente agua y oxígeno; menos comúnmente dióxido de carbono y nitrógeno. Un tema común entre estas técnicas es el uso de una alta vacío para quitar el aire y el uso de un gas inerte:: preferentemente argón, pero a menudo nitrógeno.
Los dos tipos más comunes de la técnica aire-libre implican el uso de un guantera y un Línea de Schlenk. En ambos métodos, cristalería (a menudo Tubos Schlenk) son previamente secados en antes de hornos a utilizar. Pueden ser secados al fuego para eliminar el agua adsorbido. Antes de entrar en una atmósfera inerte, los vasos se secan aún más por purga y recarga — el buque es sometido a un vacío para eliminar los gases y agua y luego rellenado con gas inerte. Este ciclo se repite normalmente tres veces, o el vacío se aplica por un período prolongado de tiempo. Una de las diferencias entre el uso de una guantera y una línea de Schlenk es donde el purga y recarga ciclo se aplica. Cuando se utiliza una guantera del purga y recarga se aplica a un bolsa de aire Unido a la guantera, comúnmente llamada el "puerto" o "ante cámaras". En contraste cuando se usa un Schlenk line el purga y recarga se aplica directamente sobre el recipiente de la reacción a través de una manguera o vidrio de tierra común que está conectado al colector.[1]
Contenido
- 1 Guantera
- 2 Línea de Schlenk
- 3 Preparaciones asociadas
- 3.1 Desgasificación
- 3.2 De secado
- 4 Alternativas
- 5 Véase también
- 6 Referencias
- 7 Enlaces externos
- 8 Galería
Guantera

El tipo más sencillo de la técnica aire-libre es el uso de un guantera. A bolsa guante utiliza la misma idea, pero es generalmente un sustituto más pobre porque es más difícil de depurar, y menos bien sellado. Existen formas innovadoras de acceder a elementos fuera del alcance de los guantes, como el uso de pinzas y cadenas. Los principales inconvenientes de usar una guantera son el costo de la guantera sí mismo y la limitada destreza usando los guantes.
En la guantera, equipos de laboratorio convencionales a menudo ser creado y manipulado, a pesar de la necesidad de manejar el aparato con los guantes. Proporcionando un sellado pero recirculando atmósfera del gas inerte, la guantera exige algunas otras precauciones. Contaminación cruzada de muestras debido a la mala técnica también es problemática, especialmente cuando una guantera es compartida entre los trabajadores que usan diferentes reactivos, volátil unos en particular.
Dos estilos han evolucionado en el uso de guanteras para química sintética. En un modo más conservador, se utilizan solamente para almacenar, pesar y transferir aire-sensible reactivos. Reacciones después de eso se llevan a cabo utilizando técnicas Schlenk. Las guanteras así sólo se utilizan para las etapas más sensibles al aire en un experimento. En su uso más liberal, guanteras se utilizan para las operaciones sintéticas enteras incluyendo reacciones en disolventes, trabajo y preparación de muestras para espectroscopia.
No todos los reactivos y disolventes son aceptables para su uso en la guantera, aunque una vez más, diferentes laboratorios adoptan diferentes culturas. La "atmósfera de caja" es generalmente continuamente desoxigenada sobre un catalizador de cobre. Ciertos químicos volátiles tales como los compuestos halogenados y la coordinación especialmente fuertemente especies tales como fosfinas y tioles puede ser problemático ya que envenenan irreversiblemente el catalizador de cobre. Debido a este problema, muchos investigadores optan manejar dichos compuestos utilizando técnicas Schlenk. En el uso más liberal de guanteras, se acepta que el catalizador de cobre se requiere reemplazo más frecuente pero este costo se considera un compromiso aceptable para la eficacia de la realización de una síntesis de todo dentro de un ambiente protegido
Línea de Schlenk

La otra técnica principal para la preparación y la entrega de compuestos sensibles al aire están asociados con el uso de una línea de Schlenk. Las principales técnicas son:
- contraflujo adiciones, donde aire-estable reactivos se agregan al recipiente de reacción contra un flujo de gas inerte.
- el uso de jeringas y tabiques de goma (tapones que sellarlo después de pinchar) para transferir líquidos y soluciones
- transferencia de cánula, donde se transfieren líquidos o soluciones de los reactivos sensibles al aire entre distintos vasos cierre hermético con tabiques utilizando un tubo largo y fino conocido como una cánula. Flujo de líquido se obtiene mediante presión de vacío o gas inerte.[2]
 Una cánula se utiliza para transferir THF del frasco de la derecha en el matraz de la izquierda.
Una cánula se utiliza para transferir THF del frasco de la derecha en el matraz de la izquierda.
Cristalería son generalmente conectado via firmemente ajustada y engrasada juntas de vidrio esmerilado. Ronda de curvas de tubos de vidrio con vidrio esmerilado juntas pueden utilizarse para ajustar la orientación de varios vasos. Filtraciones pueden lograrse por equipo dedicado.
Preparaciones asociadas
Comercialmente disponible purificada gas inerte (argón o nitrógeno) es adecuado para la mayoría de los propósitos. Sin embargo, para ciertas aplicaciones, es necesario eliminar más agua y oxígeno. Esta purificación adicional puede ser realizada por tuberías la línea de gas inerte a través de una columna de calefacción de cobre catalizador de, que convierte el oxígeno al óxido de cobre. Se extrae el agua por tuberías el gas a través de una columna de desecante como Pentóxido de fósforo soluble o tamices moleculares.
Aire y agua libre de solventes también son necesarios. Si se dispone de nitrógeno purgado de solventes de alta pureza Winchesters, pueden introducirse directamente en la guantera. Para el uso con la técnica de Schlenk, puede ser rápidamente vertieron en Matraces de Schlenk cargado con tamices moleculares, y desgasificado. Más típicamente, solvente se dispensa directamente de una columna de purificación aún o solvente.
Desgasificación
Dos procedimientos para la desgasificación son comunes. La primera se conoce como bomba-hielo-deshielo — el solvente se congela bajo nitrógeno líquido, y se aplica un vacío. Después de eso, se cierra la llave de paso y el solvente es descongelado en agua tibia, permitiendo atrapadas burbujas de gas a escapar.[3]
El segundo procedimiento es simplemente someter el disolvente al vacío. Agitación mecánica o agitación utilizando un ultrasonicador es útil. Gases disueltos evolucionan primero; una vez que el solvente comienza a evaporarse, observado por la condensación fuera de las paredes del matraz, el matraz se rellena con gas inerte. Ambos procedimientos se repiten tres veces.
De secado

Los solventes son una fuente importante de contaminación en las reacciones químicas. Aunque las técnicas tradicionales de secado involucran destilación de una agresiva desecante, tamices moleculares son muy superiores.[4]
| Agente de secado | Duración del secado | contenido de agua |
|---|---|---|
| no se trata | 6. | 225 ppm |
| Sodio/benzofenona | 48 h | 31 ppm |
| 3 tamices moleculares A | 24 h | 0,9 ppm |
Aparte de ser ineficiente, sodio como un desecante (por debajo de su punto de fusión) reacciona lentamente con trazas de agua. Cuando sin embargo, el desecante es soluble, se acelera la velocidad de secado, aunque todavía inferior a los tamices moleculares. Benzofenona a menudo se utiliza para generar a un agente de secado tan soluble. Una ventaja de esta aplicación es el color azul intenso de la ketyl radical anión. Por lo tanto, sodio/benzofenona puede utilizarse como un indicador de las condiciones de aire libre y libre de humedad en la purificación de disolventes por destilación.[5][6]
Alambiques de destilación son riesgos de incendio y cada vez más están siendo reemplazados por sistemas de secado de disolventes alternativos. Populares son los sistemas para la filtración de disolventes desoxigenadas a través de columnas llenas con activado alúmina.[7]
Secado de sólidos puede ser provocado por almacenar el sólido sobre un agente de secado tales como Pentóxido de fósforo soluble (P
2O
5) o gel de sílice, almacenar en una horno y vacío-secado estufa, calefacción bajo alto vacío o en un pistola de secado, o para separar trazas de agua, simplemente guardar el sólido en una guantera que tiene una atmósfera seca.
Alternativas
Ambas estas técnicas requieren un equipo bastante caro y pueden llevar mucho tiempo. Donde el aire libre no es estrictas, pueden utilizarse otras técnicas. Por ejemplo, usando un exceso de sacrificio de un reactivo que reacciona con agua y oxígeno puede ser utilizado. El exceso de sacrificio en efecto "seque" la reacción por reacción con el agua (e.g. en el solvente). Sin embargo, este método sólo es adecuado cuando las impurezas producidas en esta reacción no son a su vez perjudiciales para el producto deseado de la reacción o se pueden quitar fácilmente. Normalmente, las reacciones usando un exceso tal sacrificio sólo son eficaces cuando haciendo reacciones en una escala razonablemente grande tal que por esta reacción es insignificante en comparación con la reacción del producto deseado. Por ejemplo, al preparar Reactivos de Grignard, magnesio (el reactivo más barato) se utiliza a menudo en exceso, que reacciona para eliminar el agua del rastro, ya sea por reaccionar directamente con agua para dar hidróxido de magnesio o a través de la in situ formación de la Reactivo de Grignard que a su vez reacciona con el agua (por ejemplo R-Mg-X + H2O → HO-Mg-X + R-H). Para mantener el ambiente "seco" resultante es generalmente suficiente conectar un tubo protector lleno de cloruro de calcio a la condensador de reflujo con lenta humedad vuelve a entrar en la reacción con el tiempo, o conecta un línea de gas inerte.
Secado puede lograrse también mediante el uso de in situ absorbentes de humedad tales como tamices moleculares, o el uso de destilación azeotrópica técnicas por ejemplo, con un Aparato de Dean-Stark.
Véase también
- Aspersión (química)
- Desgasificación
Referencias
- ^ Duward F. Shriver y M. A. Drezdzon "La manipulación de compuestos sensibles al aire" 1986, J. Wiley e hijos: Nueva York. ISBN 0-471-86773-X.
- ^ Marrón, H. C. "Síntesis orgánica vía boranos" John Wiley & Sons, Inc. Nueva York: 1975. ISBN 0-471-11280-1.
- ^ "Bomba-hielo-deshielo desgasificación de líquidos" (PDF). Universidad de Washington.
- ^ Williams, D. G. B., Lawton, M., "secado de solventes orgánicos: evaluación cuantitativa de la eficacia de varios desecantes", el diario de la química orgánica 2010, vol. 75, 8351. doi: 10.1021/jo101589h
- ^ Nathan L. Bauld (2001). "Unidad 6: los radicales del anión". Universidad de Texas.
- ^ W. L. F. Armarego y Chai C. (2003). Purificación de productos químicos de laboratorio. Oxford: Butterworth-Heinemann. ISBN0-7506-7571-3.
- ^ Pangborn, A. B.; Giardello, M. A.; Grubbs, R. H.; Rosen, K. R. y Timmers, F. J. (1996). "Procedimiento seguro y conveniente para la purificación del solvente". Compuestos organometálicos 15 (5): 1518 – 20. doi:10.1021/om9503712.
Enlaces externos
- Rob Toreki (2004-05-24). "Cajas de guante". La galería de cristal. Paradigmas de aprendizaje interactivo incorporados.
- Rob Toreki (2004-05-25). "Líneas de Schlenk y vacío". La galería de cristal. Paradigmas de aprendizaje interactivo incorporados.
- Jürgen Heck. "El curso de síntesis integrada: Schlenk técnica" (REIMPRESIÓN EN LA UNIVERSIDAD NORUEGA DE CIENCIA Y TECNOLOGÍA). Universidad de Hamburgo.
- "AL-134: manipulación y almacenamiento de los reactivos sensibles al aire" (PDF). Boletín técnico. Sigma-Aldrich.
- R. John Errington. "Química inorgánica y metalorganic práctica avanzada".
- John Leonard, B. Lygo, Garry Procter. "Química orgánica práctica avanzada".
Galería
-
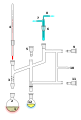
Triángulo de Perkin:: Destilación aire-sensible
-
Filtración de aire-libre
-

Aire libre sublimación
-
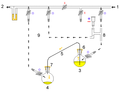
Cánula: válvula de purga dentro
-

Cánula: válvula de purga extra
-

Cánula: No (Simple) válvula de purga
-

Cánula: sistema múltiple de dos
-
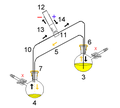
La cánula: válvula de la jeringa
-

Llave de teflón para las muestras de NMR de aire-sensible








