Trifosfato de adenosina
| Trifosfato de adenosina | |
|---|---|
 |
|
 |
|
 |
|
|
Nombre de IUPAC
[(2'' R'', 3'' S'', 4'' R'', 5'' R'') fosfato-5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methyl(hydroxyphosphonooxyphosphoryl)hydrogen |
|
|
Otros nombres
adenosina 5'-(triphos trifosfato) |
|
| Identificadores | |
| Número del CAS | 56-65-5 |
| PubChem | 5957 |
| ChemSpider | 5742 |
| UNII | 8L70Q75FXE |
| DrugBank | DB00171 |
| KEGG | C00002 |
| ChEBI | CHEBI:15422 |
| ChEMBL | CHEMBL14249 |
| Ligando IUPHAR | 1713 |
| Jmol-Imágenes 3D | Imagen 1 Imagen 2 |
|
SONRISAS
|
|
|
InChI
|
|
| Propiedades | |
| Fórmula molecular | C10H16N5O13P3 |
| Masa molar | mol 507,18 g−1 |
| Densidad | 1,04 g/cm3 (sal disódica) |
| Punto de fusión | Sal disódica del de 187 ° C (° F 369; 460 K); se descompone |
| Acidez (p)Ka) | 6.5 |
| Excepto que se señala lo contrario, se dan datos para materiales en su estado de agregacion (a 25 ° C (77 ° F), 100 kPa) | |
| |
|
| Infobox referencias | |
Trifosfato de adenosina (BT3) es un trifosfato nucleósido utilizado en células como un coenzima.
A menudo se llama el "molecular unidad de moneda"de intracelular energía transferencia.[1] ATP transporta energía química dentro de células para metabolismo. Es uno de los productos finales de fotofosforilación, respiración celular, y fermentación y utilizado por enzimas y proteínas estructurales en muchos procesos celulares, incluyendo reacciones biosintéticas, motilidad, y división celular.[2] Una molécula de ATP contiene tres grupos fosfato y es producido por una gran variedad de enzimas, incluyendo ATP sintasaDe difosfato de adenosina (ADP) o monofosfato de adenosina (AMP) y diversos donantes de grupos fosfato. Nivel de sustrato fosforilación, fosforilación oxidativa en respiración celular, y fotofosforilación en fotosíntesis son tres principales mecanismos de biosíntesis de ATP.
Procesos metabólicos que utilizan el ATP como fuente de energía convierten a sus precursores. ATP por lo tanto se recicla continuamente en los organismos: el cuerpo humano, que en promedio contiene sólo 250 gramos (8,8 oz) de ATP,[3] vuelca su propio peso corporal equivalente en ATP cada día.[4]
ATP es utilizado como un sustrato en transducción de señales vías por quinasas que fosforilan proteínas y lípidos. También es utilizado por Adenilato ciclasa, que utiliza el ATP para producir la segundo mensajero molécula AMP cíclico. La relación entre ATP y AMP se utiliza como una forma para una celda para detectar cuánta energía está disponible y control de la vías metabólicas Producimos y consumimos ATP.[5] Aparte de sus funciones en el metabolismo de señalización y energía, ATP también se incorpora a ácidos nucleicos por polimerasas en el proceso de Transcripción. El ATP es el neurotransmisor que se cree que el sentido del gusto de la señal.[6]
La estructura de esta molécula consiste en un Purina base)adenina) conectado al 1' átomo de carbón de un pentosa azúcar)ribosa). Tres grupos fosfato se unen en el átomo de carbón de 5' del azúcar pentosa. Es la adición y eliminación de estos grupos fosfato que convertir entre ATP, ADP y AMP. Al ATP se utiliza en la síntesis de ADN, primero se convierte el azúcar ribosa desoxirribosa por reductasa ribonucleótido.
ATP fue descubierto en 1929 por Karl Lohmann, Fiske y Y. Subbarow de Harvard Medical School[7] Pero no se determinó su estructura correcta hasta algunos años más tarde.[citación necesitada] Se propuso que la molécula de transferencia de energía en la célula por Fritz Albert Lipmann en 1941, es decir, siendo la molécula intermediaria entre el rendimiento de energía (exergónico) y reacciones de la energía-requerir (endergónico).[8] Lo primero fue sintetizado artificialmente por Alexander Todd en 1948.[9]
Contenido
- 1 Propiedades físicas y químicas
- 1.1 Ionización en sistemas biológicos
- 2 Biosíntesis de
- 2.1 Glucólisis
- 2.2 Glucosa
- 2.3 Beta oxidación
- 2.4 Fermentación
- 2.5 Respiración anaerobia
- 2.6 Reposición del ATP por cinasas nucleósido difosfato
- 2.7 Producción de ATP durante la fotosíntesis
- 2.8 Reciclaje de ATP
- 3 Regulación de la biosíntesis de
- 4 Funciones de las células
- 4.1 Metabolismo, síntesis y transporte activo
- 4.2 Roles en la estructura celular y locomoción
- 4.3 Señalización celular
- 4.3.1 Señalización extracelular
- 4.3.2 Señalización intracelular
- 4.4 Síntesis de DNA y RNA
- 5 Activación del aminoácido en la síntesis de proteínas
- 6 Unión a proteínas
- 7 Análogos de la ATP
- 8 Véase también
- 9 Referencias
- 10 Enlaces externos
Propiedades físicas y químicas
Consiste en ATP adenosina— compuesto por una adenina anillo y un ribosa azúcar — y tres fosfato grupos (trifosfato). Los grupos fosforilo, comenzando con el grupo más cercano a la ribosa, se conocen como el alfa (α), beta (β) y los fosfatos gamma (γ). Por consiguiente, está estrechamente vinculada a los nucleótidos de adenosina, un monómero de ARN. ATP es altamente soluble en agua y es bastante estable en soluciones entre pH 6.8 y 7.4, pero es rápidamente hidrolizado en pH extremos. En consecuencia, ATP se almacena mejor como una sal anhidra.[10]
El ATP es una molécula inestable en sin memoria intermedia agua, en el cual que hidroliza a ADP y fosfato. Esto es porque la fuerza de los vínculos entre los grupos fosfato en ATP es menor que la fuerza de la enlaces de hidrógeno (bonos de hidratación), entre sus productos (ADP + fosfato) y el agua. Por lo tanto, si la ATP y ADP son en equilibrio químico en el agua, casi la totalidad de la ATP con el tiempo se convertirá al ADP. Contiene un sistema alejado del equilibrio Energía libre de Gibbsy es capaz de hacer trabajo. Las células vivas mantengan la proporción de ATP a ADP en un punto diez órdenes de magnitud de equilibrio, con concentraciones de ATP cinco veces superiores a la concentración de ADP. Este desplazamiento del equilibrio significa que la hidrólisis de ATP en la célula libera una gran cantidad de energía libre.[11]
Dos phosphoanhydride bonos (los que conectan los fosfatos adyacentes) en una molécula de ATP son responsables por el contenido de esta molécula de alta energía.[12] En el contexto de las reacciones bioquímicas, estos bonos anhídrido son con frecuencia — y a veces polémico — denominado bonos de alta energía (a pesar del hecho se necesita energía para romper lazos).[13] Energía almacenada en ATP puede ser liberado al hidrólisis de los bonos de anhídrido.[12] El grupo fosfato primario en la molécula de ATP que es hidrolizado cuando se necesita energía para las reacciones anabólicas en coche es el γ-fosfato. Situado a la más lejana del azúcar ribosa, tiene una alta energía de hidrólisis que cualquiera la α o β-fosfato. Los bonos se formaron después de la hidrólisis — o la fosforilación de residuos por ATP — son más bajas en energía que los lazos phosphoanhydride de ATP. Durante la hidrólisis enzimática catalizada de ATP o fosforilación por el ATP, la energía libre disponible puede reforzarse mediante un sistema de vida para hacer el trabajo.[14][15]
Cualquier sistema inestable de moléculas potencialmente reactivas potencialmente podría servir como una forma de almacenar energía libre, si la célula mantiene su concentración lejos del punto de equilibrio de la reacción.[11] Sin embargo, como es el caso de las biomoléculas más poliméricos, la ruptura de ATP, DNA y RNA en monómeros más simples es conducida por consideraciones tanto liberación de energía y entropía-aumento, en tanto las concentraciones estándar y también aquellas concentraciones encontradas dentro de la célula.
Puede calcular la cantidad de energía liberada de la hidrólisis de ATP estándar de los cambios de energía en condiciones no naturales (estándar), luego corregir a concentraciones biológicas. El cambio neto en energía (de calorentalpía) en presión y temperatura estándar de la descomposición del ATP en hidratado ADP y fosfato inorgánico hidratado es −20.5kJ/mol, con un cambio en energía libre de 3.4 kJ/mol.[16] La energía liberada por unirse o un fosfato (p)i) o pirofosfato (PPi) unidad de ATP en estado de agregacion de 1 M son:[17]
-
ATP +
H
2O → ADP + P i ΔG˚ = −30.5 kJ/mol (−7.3 kcal/mol) -
ATP +
H
2O → AMP + PP i ΔG˚ = −45.6 kJ/mol (−10.9 kcal/mol)
Estos valores pueden utilizarse para calcular el cambio en energía bajo condiciones fisiológicas y la relación ATP/ADP celular. Sin embargo, un valor más representativo (que toma AMP en consideración) llama la Carga de energía cada vez más está siendo empleado. Los valores indicados para el Energía libre de Gibbs para esta reacción dependen de varios factores, incluyendo la fuerza iónica total y la presencia de Alcalinotérreo iones tales como Mg2+
y Ca2+
. Bajo condiciones típicas de celulares, ΔG es aproximadamente −57 kJ/mol (−14 kcal/mol).[18]
Ionización en sistemas biológicos
ATP (trifosfato de adenosina) tiene varios grupos con diferentes constantes de disociación ácida. En solución neutra, ATP está ionizado existe principalmente como ATP4−, con una pequeña proporción de ATP3−.[19] Como ATP tiene varios grupos cargados negativamente en solución neutra, puede Quelato metales con muy alta afinidad. El constante de Unión para varios iones metálicos (figuran según topo) como Mg2+
(9 554), Na+
(13), Ca2+
(722 3), K+
(8), Sr2+
(1 381) y Li+
(25).[20] Debido a la fuerza de estas interacciones, ATP existe en la célula principalmente en un complejo con Mg2+
.[19][21]
Biosíntesis de
La ATP concentración dentro de la célula es típicamente 1 – 10 mM.[22] ATP puede ser producido por redox reacciones utilizando simples y complejos azúcares (hidratos de carbono) o lípidos como fuente de energía. De los complejos combustibles para ser sintetizados en ATP, primero necesitan dividirse en moléculas más pequeñas, más simples. Los carbohidratos son hidrolizado en azúcares simples, tales como glucosa y fructosa. Grasas)triglicéridos) son metabolizados para dar ácidos grasos y glicerol.
El proceso global de oxidación de glucosa dióxido de carbono se conoce como respiración celular y puede producir unos 30 moléculas de ATP de una sola molécula de glucosa.[23] ATP puede ser producido por un número de procesos celulares distintos; las tres principales vías para generar energía en eucariotas los organismos son glucólisis y el ciclo del ácido cítrico/fosforilación oxidativa, ambos componentes de respiración celular; y beta-oxidación. La mayoría de esta producción de ATP por un no-fotosintética eucariotas aeróbicas lleva a cabo el mitocondria, que puede hacer casi el 25% del volumen total de una célula típica.[24]
Glucólisis
En la glicolisis, la glucosa y el glicerol se metabolizan a piruvato vía el camino glicolítico. En la mayoría de los organismos, este proceso ocurre en el citosol, pero, en algunos protozoos tales como la kinetoplástidos, se lleva a cabo en un organismo especializado orgánulo llamado el glycosome.[25] Glicolisis genera un neto de dos moléculas de ATP a través de fosforilación de sustrato catalizada por dos enzimas: PGK y piruvato quinasa. Dos moléculas de NADH también se producen, que puede ser oxidado por el cadena de transporte de electrones y el resultado en la generación de ATP adicional por ATP sintasa. El piruvato generado como un producto final de la glicolisis es un sustrato para la Ciclo de Krebs.[26]
Glucosa
En mitocondria, piruvato es oxidado por el complejo piruvato deshidrogenasa al grupo acetilo, que es completamente oxidado a dióxido de carbono por el ciclo del ácido cítrico (también conocido como el ciclo de Krebs). Cada "vuelta" el ciclo del ácido cítrico produce dos moléculas de dióxido de carbonouna molécula del equivalente del ATP guanosín trifosfato (GTP) a través de nivel de sustrato fosforilación catalizada por sintetasa Succinil-CoAtres moléculas de la reducción coenzima NADHy una molécula de la coenzima reducida FADH2. Ambas de estas últimas moléculas son reciclados a sus Estados oxidados (NAD+ y FADrespectivamente) mediante la cadena de transporte de electrones, lo que genera ATP adicional por fosforilación oxidativa. La oxidación de una molécula de NADH da lugar a la síntesis de moléculas de ATP 2 – 3 y la oxidación del uno FADH2 rendimientos entre 1 – 2 moléculas de ATP.[23] La mayoría de ATP celular es generada por este proceso. Sin el ciclo del ácido cítrico se implique molecular oxígeno, es un obligatoriamente aeróbico proceso porque O
2 es necesario para reciclar el reducido NADH y FADH2 a sus Estados oxidados. En ausencia de oxígeno el ciclo del ácido cítrico dejará de funcionar debido a la falta de NAD disponible+ y el FAD.[24]
La generación de ATP en la mitocondria de NADH citosólico se basa en la lanzadera de malato-aspartato (y en menor medida, la lanzadera de glicerol-fosfato) porque la membrana mitocondrial interna es impermeable a NADH y NAD+. En lugar de transferir el NADH generado, un Malato deshidrogenasa enzima convierte oxaloacetato Para malato, que se desplaza a la matriz mitocondrial. Otro Malato deshidrogenasa-catalizada reacción se produce en la dirección opuesta, produciendo oxaloacetato y NADH desde el malato recién transportado y tienda interior de NAD de la mitocondria+. A transaminasa convierte el oxaloacetato a aspartato para el transporte a través de la membrana y en el espacio del intermembrane.[24]
En la fosforilación oxidativa, el paso de los electrones del NADH y FADH2 a través del transporte de electrones cadena alimenta el bombeo de protones fuera de la matriz mitocondrial y en el espacio del intermembrane. Esto crea una la fuerza móvil de protones es decir, el efecto neto de un pH gradiente y una potencial eléctrico gradiente a través de la membrana mitocondrial interna. Flujo de protones hacia abajo este gradiente potencial — es decir, desde el espacio intermembrane a la matriz — proporciona la fuerza impulsora para la síntesis de ATP por ATP sintasa. Esto enzima contiene una subunidad del rotor que gira físicamente en relación con las partes estáticas de la proteína durante la síntesis de ATP.[27]
La mayoría de los ATP sintetizado en la mitocondria se utilizará para los procesos celulares en el citosol; por lo tanto deben ser exportado desde su sitio de síntesis en la matriz mitocondrial. La membrana interna contiene un Antiporter, la ADP/ ATP translocasa, que es un proteína integral de membrana utilizado para el intercambio ATP recién sintetizada en la matriz para ADP en el espacio del intermembrane.[28] Este translocase es conducida por la membrana potencial, como resulta en el movimiento de unos 4 cargas negativas de la membrana mitocondrial a cambio de 3 cargas negativas que se movió dentro. Sin embargo, también es necesario para el transporte de fosfato en la mitocondria; el portador de fosfato mueve un protón con cada fosfato, parcialmente disipando el gradiente de protones.
Beta oxidación
Los ácidos grasos también puede romperse a Acetil-CoA por beta-oxidación. Cada ronda de este ciclo reduce la longitud de la cadena del acyl por dos átomos de carbono y produce un NADH y un FADH2 molécula, que se utilizan para generar ATP por fosforilación oxidativa. Porque NADH y FADH2 son moléculas ricas en energía, docenas de moléculas de ATP pueden ser generadas por la beta-oxidación de una cadena única larga acil. El rendimiento de alta energía de este proceso y el almacenaje compacto de grasa explicar por qué es la fuente más densa de la dieta calorías.[29]
Fermentación
Fermentación implica la generación de energía mediante el proceso de nivel de sustrato fosforilación en ausencia de una respiratoria cadena de transporte de electrones. En la mayoría de eucariotas, la glucosa se utiliza como donante de electrones y un acumulador de energía. La ecuación para la oxidación de la glucosa a ácido láctico es:
-
C
6H
12O
6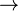 2
CH
2
CH
3CH (OH) COOH + 2 ATP
Respiración anaerobia
Respiración anaerobia es el proceso de respiración usando un aceptador del electrón otros que O
2. En procariotas, múltiples Aceptadores del electrón pueden utilizarse en la respiración anaerobia. Estos incluyen nitrato, sulfato o dióxido de carbono. Estos procesos conducen a los procesos ecológicamente importantes de desnitrificación, reducción de sulfato y acetogénesis, respectivamente.[30][31]
Reposición del ATP por cinasas nucleósido difosfato
También se puede sintetizar ATP a través de varias reacciones supuestas "reposición" catalizadas por las familias de la enzima de quinasas nucleósido difosfato (NDKs), que utilizan otros trifosfatos de nucleósidos como donante de fosfato de alta energía y la ATP:guanido-fosfotransferasa familia,
Producción de ATP durante la fotosíntesis
En las plantas, el ATP se sintetiza en membrana TILACOIDE de la cloroplasto durante el reacciones dependientes de la luz de fotosíntesis en un proceso llamado fotofosforilación. Aquí, energía de la luz se utiliza para bombear protones a través de la membrana del cloroplasto. Esto produce una fuerza protón-motriz y esto impulsa el ATP synthase, exactamente igual que en la fosforilación oxidativa.[32] Algunos de los ATP producido en los cloroplastos se consume en el Ciclo de Calvin, que produce Triosa azúcares.
Reciclaje de ATP
La cantidad total de ATP en el cuerpo humano es de 0.2Mole. La mayoría de ATP no se sintetiza generalmente de novo, pero se genera a partir ADP por dichos procesos. Así, en cualquier momento, la cantidad total de ATP + ADP sigue siendo bastante constante.
La energía utilizada por las células humanas requiere la hidrólisis de 100 a 150 moles de ATP diariamente, que es alrededor de 50 a 75 kg. Un ser humano suelen utilizar encima de su peso corporal de ATP en el transcurso del día.[33] Esto significa que cada molécula de ATP es reciclado 500 a 750 veces durante un solo día (100 / 500 = 0.2). ATP no puede ser almacenado, por lo tanto, su consumo sigue de cerca su síntesis. Sin embargo un total de alrededor de 5g del ATP es utilizado por procesos de la célula en cualquier momento en el cuerpo.
Regulación de la biosíntesis de
La producción de ATP en una célula eucariota aerobia es estrictamente regulada por alostérica mecanismos, por retroalimentación efectos y por la dependencia de la concentración de sustrato de las enzimas individuales dentro de las vías glucólisis y fosforilación oxidativa. Puntos clave de control se producen en las reacciones enzimáticas que son tan enérgio favorables que son efectivamente irreversibles bajo condiciones fisiológicas.
En la glicolisis, hexoquinasa directamente es inhibido por su producto, glucosa-6-fosfato, y piruvato quinasa es inhibida por ATP sí mismo. Es el punto de control principal para el camino glicolítico Fosfofructoquinasa (PFK), que allosterically es inhibida por altas concentraciones de ATP y activado por altas concentraciones de AMP. La inhibición de la PFK por ATP es inusual, ya que el ATP es también un sustrato en la reacción catalizada por la PFK; la forma biológicamente activa de la enzima es un tetrámero que existe en dos conformaciones posibles, sólo uno de los cuales une el segundo sustrato fructosa-6-fosfato (F6P). La proteína tiene dos sitios de Unión ATP — el sitio activo es accesible en cualquier conformación proteica, pero ATP binding al sitio inhibidor estabiliza la conformación que ata F6P mal.[26] Un número de otras moléculas pequeñas puede compensar el cambio inducido por ATP en conformación de equilibrio y reactivar PFK, incluyendo AMP cíclico, amonio los iones de fosfato inorgánico y fructosa 1,6 y 2,6 bifosfato.[26]
El ciclo del ácido cítrico está regulado principalmente por la disponibilidad de sustratos claves, particularmente la relación de NAD+ NADH y las concentraciones de calcio, fosfato inorgánico, ATP, ADPy AMP. Citrato — la molécula que da nombre al ciclo — es un inhibidor de la retroalimentación de citrato sintasa y también inhibe la PFK, proporcionando un enlace directo entre la regulación del ciclo de ácido cítrico y la glucólisis.[26]
En la fosforilación oxidativa, el punto clave de control es la reacción catalizada por citocromo c oxidasa, que está regulada por la disponibilidad de su sustrato, la forma reducida del citocromo c. La cantidad de reducción del citocromo c disponible está directamente relacionada con las cantidades de otros substratos:
directamente lo que implica esta ecuación:
Por lo tanto, una alta relación de [NADH] a [NAD+] o un cociente bajo de [ADP] [Pi] a [ATP] implica una alta cantidad de reducción del citocromo c y un alto nivel de actividad del citocromo c oxidasa.[26] Se introduce un nivel adicional de regulación por las tarifas de transporte de ATP y NADH entre la matriz mitocondrial y el citoplasma.[28]
Funciones de las células
Metabolismo, síntesis y transporte activo
ATP se consume en la célula por procesos (endotérmicos) que requieren energía y puede ser generado por procesos (exotérmicos) liberador de energía. En esta forma ATP transferencias energía entre espacialmente separado reacciones metabólicas. El ATP es la principal fuente de energía para la mayoría de las funciones celulares. Esto incluye la síntesis de macromoléculas, incluyendo ADN y ARN (véase abajo), y proteínas. ATP también desempeña un papel crítico en la transporte de macromoléculas a través de las membranas celulares, por ejemplo exocitosis y endocitosis.
Roles en la estructura celular y locomoción
ATP críticamente está implicado en el mantenimiento de la estructura celular facilitando el montaje y desmontaje de los elementos de la citoesqueleto. En un proceso relacionado, el ATP se requiere para el acortamiento de crossbridges filamentos de actina y miosina requerido para contracción del músculo. Este último proceso es uno de los requisitos de energía de los animales y es esencial para locomoción y respiración.
Señalización celular
| Parte de una serie en |
| Señalización purinérgicos |
|---|

Ilustración simplificada de señalización extracelular purinérgicos
|
| Conceptos |
| Señalización purinérgicos
|
| Transportadores de membrana |
| Transportadores de nucleósidos
|
Señalización extracelular
El ATP es también un molécula señalizadora. Adenosina, ATP o ADP son reconocidos por receptores purinérgicos. Purinoreceptors podría ser los receptores más abundantes en los tejidos mamíferos.[34]
En los seres humanos, este papel de señalización es importante en el sistema nervioso central y periférico.[35] Liberación dependiente de actividad de ATP de sinapsis, los axones y glia activa receptores de membrana purinérgicos conocidos como P2.[36] El P2Y los receptores son metabotrópicos, es decir, Acoplado a proteínas G y modulan principalmente calcio intracelular y a veces los niveles de AMP cíclico. Aunque el nombre entre P2Y1 y P2Y15, sólo nueve miembros de la familia P2Y han sido clonados, y algunos sólo están relacionados a través de homología débil y varios (P2Y5P2Y7P2Y9P2Y10) no funcionan como receptores que elevar el calcio citosólico. El P2X ionotrópicos subgrupo del receptor compone de siete miembros (P2X1– P2X7), que son ligand-bloqueado Ca2+
-canales iónicos permeables que se abren cuando atados a un nucleótido de purina extracelular. En contraste con los receptores P2 (orden agonista ATP > ADP > AMP > ADO), purinérgicos trifosfatos de nucleósidos como ATP no son fuertes agonistas de los receptores P1, que son fuertemente activados por adenosina y otros nucleósidos (ADO > AMP > ADP > ATP). Los receptores P1 tienen subtipos A1, A2a, A2b y A3 ("A" como un remanente de la vieja nomenclatura de receptor de adenosina), todos los cuales son receptores acoplados a proteína G, A1 y A3 ser acoplado a Gi y A2a y A2b ser acoplado a Gs.[37] Todos los receptores de adenosina fueron demostrados para activar al menos una subfamilia de kinases de proteína mitogen-activados. Las acciones de la adenosina suelen ser antagónicos o sinérgicos a las acciones de ATP. En el SNC, adenosina tiene funciones múltiples, tales como la modulación del desarrollo neuronal, neuronal y glial de señalización y control de sistemas inmune innatos y adaptativos.[34]
Señalización intracelular
El ATP es crítico en transducción de señales procesos. Es utilizado por quinasas como la fuente de los grupos fosfato en sus reacciones de transferencia de fosfato. Actividad de la cinasa en sustratos tales como proteínas o lípidos de membrana son una forma común de transducción de señales. Fosforilación de una proteína por una quinasa puede activar esta cascada como la proteína quinasa activada por mitógeno cascada.[38]
ATP también es utilizado por Adenilato ciclasa y se transforma en el segundo mensajero molécula de AMP cíclico, que participa en el desencadenamiento de las señales de calcio por la liberación de calcio de almacenes intracelulares.[39] Esta forma de transducción de la señal es particularmente importante en el funcionamiento del cerebro, aunque está implicado en la regulación de una multitud de otros procesos celulares.[40]
Síntesis de DNA y RNA
En todos los organismos conocidos, los desoxirribonucleótidos conforman ADN son sintetizados por la acción de reductasa ribonucleótido Enzimas (RNR) en sus correspondientes ribonucleótidos.[41] Estas enzimas reducen los residuos de azúcar de ribosa Para desoxirribosa mediante la eliminación de oxígeno de la 2' hidroxilo Grupo; los sustratos son difosfatos ribonucleósido y los difosfatos de desoxinucleósidos productos (estos últimos son dADP denota, dCDP, dGDP y dUDP respectivamente). Las enzimas de ribonucleótido reductasa usan común Sulfidrilo radical mecanismo dependiente de reactivos cisteína residuos que se oxidan para formar disulfuro en el curso de la reacción.[41] Las enzimas RNR son recicladas por reacción con tiorredoxina o Reductasas.[26]
La regulación de RNR y enzimas relacionadas mantiene un equilibrio de dNTPs en relación con los demás y en relación con los PNT en la célula. Concentración muy baja de dNTP inhibe Síntesis de ADN y Reparación del ADN y es letal para la célula, mientras que una proporción anormal de dNTPs es mutágenos debido a la creciente probabilidad de que el ADN polimerasa la incorporación del dNTP incorrecto durante la síntesis de ADN.[26] Reglamento de o especificidad diferencial de RNR se ha propuesto como un mecanismo para las alteraciones en los tamaños relativos de dNTP intracelular piscinas bajo estrés celular tales como hipoxia.[42]
En la síntesis de la ácidos nucleicos ARN, adenosina derivado del ATP es uno de los cuatro nucleótidos incorporados directamente en las moléculas de ARN por ARN polimerasas. La energía que conduce esta polimerización proviene de unirse a un pirofosfato (dos grupos de fosfato).[43] El proceso es similar en la biosíntesis de ADN, excepto que el ATP se reduce a la desoxirribonucleótido dATP, antes de la incorporación en el ADN.
Activación del aminoácido en la síntesis de proteínas
Enzimas aminoacil-tRNA sintetasa utilizan ATP como fuente de energía para fijar una molécula de tRNA a su aminoácido específico, formando un aminoacil-tRNA complejo, listo para traducción en ribosomas. La energía se pone a disposición de la hidrólisis de ATP para monofosfato de adenosina (AMP) como fosfato dos grupos se retiran.[44]
Unión a proteínas
Algunas proteínas que se unen ATP hacerloen en una característica doblez de proteína conocido como el Pliegue Rossmann, que es un general nucleótido-enlace dominio estructural Eso también puede enlazar el coenzima NAD.[45] Las proteínas de unión a ATP más común, conocidas como quinasas, comparten un pequeño número de pliegues común; el proteínas quinasas, la más grande Superfamilia quinasa, todos compartir características estructurales comunes especializan para ATP vinculante y transferencia de fosfato.[46]
ATP en complejos con proteínas, en general, requiere la presencia de un divalentes catión, casi siempre magnesio, que se une a los grupos fosfato de ATP. La presencia de magnesio disminuye grandemente la constante de disociación de ATP de su socio de atascamiento de proteína sin afectar la capacidad de la enzima para catalizar la reacción una vez la ATP ha obligado.[47] La presencia de los iones de magnesio puede servir como un mecanismo para la regulación de la quinasa.[48]

Análogos de la ATP
Laboratorios de Bioquímica utilizan a menudo in vitro estudios para explorar procesos moleculares dependiente de ATP. Inhibidores de la enzima de las enzimas dependientes de ATP como quinasas se necesitan para examinar la sitios de Unión y Estados de transición involucrados en las reacciones dependientes de ATP. Análogos del ATP también se utilizan en Cristalografía de rayos x para determinar un estructura de la proteína en complejo con el ATP, a menudo junto con otros sustratos. Análogos del ATP más útiles no pueden ser hidrolizados como ATP; en su lugar atrapan la enzima en una estructura estrechamente relacionada al estado enlazado a ATP. Adenosina 5'-(gamma-thiotriphosphate) es un análogo de ATP extremadamente comunes en los cuales uno de la gamma-fosfato oxígenos es sustituido por un azufre átomo; esta molécula es hidrolizada en funciones y una tasa significativamente más lenta que ATP sí mismo como un inhibidor de procesos dependientes de ATP. En estudios cristalográficos, hidrólisis Estados de transición son modelados por el límite vanadato ion. Sin embargo, precaución está garantizado en la interpretación de los resultados de experimentos usando análogos del ATP, puesto que algunas enzimas pueden hidrolizarlos precios apreciable en alta concentración.[49]
Véase también
- Difosfato de adenosina (ADP)
- Monofosfato de adenosina (AMP)
- Adenosina-tetraphosphatase
- ATPasas
- Prueba de la ATP
- Hidrólisis de ATP
- Ciclo del ácido cítrico (también llamado el ciclo de Krebs o ciclo TCA)
- Monofosfato de adenosina cíclico (campo)
- Factor de intercambio del nucleótido
- Fosfagenos
- Fotofosforilación
Referencias
- ^ JR. Knowles (1980). "Reacciones de transferencia de fosforilo enzima-catalizadas". Annu. El reverendo Biochem. 49:: 877 – 919. Doi:10.1146/annurev.BI.49.070180.004305. PMID6250450.
- ^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biología: Explorando la vida. Boston, Massachusetts: Pearson Prentice Hall. ISBN0-13-250882-6.
- ^ "'Las baterías de la naturaleza pueden haber ayudado a poder primeras formas de vida". Ciencia diariamente. 25 de mayo de 2010. Programa archivado de la original en 27 de mayo de 2010. 2010-05-26. "En cualquier momento, el cuerpo humano contiene sólo 250g de ATP — esto proporciona aproximadamente la misma cantidad de energía que una sola batería AA. Esta tienda de ATP está siendo constantemente utilizado y regenerada en células mediante un proceso conocido como respiración, que es conducido por catalizadores naturales llamados enzimas. "
- ^ S Törnroth-Swinburn, Neutze R (diciembre de 2008). "Abriendo y cerrando la puerta metabolito". Proc. nacional Acad. Sci U.S.A. 105 (50): 19565 – 6. Doi:10.1073/pnas.0810654106. PMC2604989. PMID19073922.
- ^ Hardie DG, Hawley SA (diciembre de 2001). "Proteincinasa activada por AMP: la hipótesis de carga de energía Revisitada". Diseñó 23 (12): 1112 – 9. Doi:10.1002/bies.10009. PMID11746230.
- ^ Tim Jacob. "Taste(gustation)". 14 de julio de 2012.
- ^ Lohmann K (agosto de 1929). "Über die Pyrophosphatfraktion im músculo en". Naturwissenschaften (en alemán) 17 (31): 624 – 5. Doi:10.1007/BF01506215.
- ^ Lipmann F (1941). ADV Enzymol. 1:: 99 – 162. ISSN0196-7398.
- ^ "Historia: ATP descubrió por primera vez en 1929". El Premio Nobel de química 1997. Fundación Nobel. 2010-05-26.
- ^ Stecher, P. G., ed. (1968). El índice de Merck: una enciclopedia de productos químicos y drogas 8ª edición. Merck and Co Ltd.
- ^ a b Ferguson, S. J.; Nicholls, David; Ferguson, Stuart (2002). Bioenergética 3 (3ª ed.). San Diego: académico. ISBN0-12-518121-3.
- ^ a b JM Berg, JL Tymoczko, L Stryer (2003). Bioquímica. Nueva York: WH Freeman. p. 376. ISBN0-7167-4684-0.
- ^ Oportunidad, B.; Lías, H.; Postgate, J. G. (1972). "El significado de"Flujo del electrón invertida"y"Electrones de alta energía"en bioquímica". Naturaleza 238 (5363): 330 – 1. Doi:10.1038/238330a0. PMID4561837.
- ^ Koolman, J.; K. Roehm H. (2005). Atlas del color de la bioquímica. Stuttgart, Alemania: Georg Thieme Verlag. p. 122. ISBN3-13-100372-3.
- ^ John Daintith, ed. (2004). Diccionario de Oxford de la química. Oxford, Inglaterra: Oxford University Press. p. 435. ISBN0-19-860918-3.
- ^ Goldberg E Gajewski, D Steckler, R (1986). "Termodinámica de la hidrólisis de la adenosina 5'-trifosfato de adenosina 5'-difosfato" (PDF). J Biol Chem 261 (27): 12733 – 7. PMID3528161.
- ^ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2007). Bioquímica (6ª ed.). Nueva York: W. H. Freeman. p. 413. ISBN0-7167-8724-5.
- ^ Stryer, Lubert (2002). Bioquímica (5ª Ed.). Nueva York: W.H. Freeman y compañía. ISBN0-7167-1843-X.
- ^ a b Almacenista A, Cornualles-Bowden un (1976). "La concentración de MgATP2− y otros iones en solución. Cálculo de las concentraciones de especies presentes en las mezclas de asociar los iones de verdaderas". Biochem J 159 (1): 1 – 5. PMC1164030. PMID11772.
- ^ Wilson J, barbilla una (1991). "Quelante de cationes divalentes por ATP, estudiado por calorimetría de titulación". Anal Biochem 193 (1): 16 – 9. Doi:10.1016/0003-2697 (91) 90036-S. PMID1645933.
- ^ Garfinkel L, Altschuld R, Garfinkel D (1986). "Magnesio en metabolismo energético cardíaco". J Mol Cell Cardiol 18 (10): 1003 – 13. Doi:10.1016/S0022-2828 (86) 80289-9. PMID3537318.
- ^ Beis I.; Newsholme e. A. (01 de octubre de 1975). "El contenido de nucleótidos de adenina, phosphagens y algunos productos intermedios glicolíticas en reposo de los músculos de los vertebrados e invertebrados". Biochem J 152 (1): 23 – 32. PMC1172435. PMID1212224.
- ^ a b Rico PR (2003). "La maquinaria molecular de la cadena respiratoria de Keilin". Biochem. Soc Trans. 31 (Pt 6): 1095 – 105. Doi:10.1042/BST0311095. PMID14641005.
- ^ a b c Lodish H Berk A, Matsudaira P, CA Kaiser, Krieger M, Scott MP, Zipursky SL, Darnell J. (2004). Biología molecular de la célula (5ª Ed.). Nueva York: WH Freeman. ISBN978-0-7167-4366-8.
- ^ Parsons M (2004). "Glycosomes: parásitos y la divergencia de propósito peroxisomal". Mol Microbiol 53 (3): 717 – 24. Doi:10.1111/j.1365-2958.2004.04203.x. PMID15255886.
- ^ a b c d e f g Voet, Voet JG d. (2004). Bioquímica 1 (3ª ed.). Hoboken, NJ.: Wiley. ISBN978-0-471-19350-0.
- ^ Abrahams J, Leslie A, Lutter R, Walker J (1994). "Estructura en resolución de 2.8 Å de F1-ATPasa de mitocondrias de corazón bovino". Naturaleza 370 (6491): 621 – 8. Doi:10.1038/370621a0. PMID8065448.
- ^ a b Dahout-Gonzalez C, Nury H, Trézéguet V, Lauquin G, Pebay-Peyroula E, Brandolin G (2006). "Aspectos moleculares, funcionales y patológicos del portador del ADP/ATP mitocondrial". Fisiología (Bethesda) 21 (4): 242 – 9. Doi:10.1152/Physiol.00005.2006. PMID16868313.
- ^ Ronnett G, Kim E, Landree L, Tu Y (2005). "Metabolismo del ácido graso como un objetivo para el tratamiento de la obesidad". Physiol Behav 85 (1): 25 – 35. Doi:10.1016/j.physbeh.2005.04.014. PMID15878185.
- ^ Zumft W (01 de diciembre de 1997). "Biología celular y molecular basis de desnitrificación". Microbiol Mol Biol Rev 61 (4): 533-616. PMC232623. PMID9409151.
- ^ Drake H, Daniel S, Küsel K, Matthies C, Kuhner C, Braus-Stromeyer S (1997). "La bacteria acetogénica: ¿Cuáles son las consecuencias de sus diversidad metabólicas versatilidades in situ?". BioFactors 6 (1): 13 – 24. Doi:10.1002/Biof.5520060103. PMID9233536.
- ^ Allen J (2002). "Fotosíntesis de ATP-electrones, protones bombas, rotores y aplomo". Celular 110 (3): 273 – 6. Doi:10.1016/S0092-8674 (02) 00870-X. PMID12176312.
- ^ Di Carlo, E. S. y Collins, L. H. (01 de junio de 2001). "Iluminaciones enviar para revisión". Advan. Physiol. Edu. 25 (2): 70 – 1.
- ^ a b Abbracchio MP, Burnstock G, Verkhratsky A, H Zimmermann (enero de 2009). "Purinérgicos señalización en el sistema nervioso: Generalidades". Trends Neurosci. 32 (1): 19 – 29. Doi:10.1016/j.Tins.2008.10.001. PMID19008000.
- ^ Chris Byrnes (05 de enero de 2012). "Tratamiento de los síntomas de neuropatía de fibra pequeña con ATP". Trabajando hacia el bienestar. 06 de enero de 2014.
- ^ Campos, R. D.; Burnstock, G. (2006). "Purinérgicos señalización en interacciones neurona-glia". Nature Neuroscience comentarios 7 (6): 423 – 36. Doi:10.1038/nrn1928. PMC2062484. PMID16715052.
- ^ Fredholm, BB; Abbracchio, MP; Burnstock, G; Daly, JW; Harden, TK; Jacobson, KA; Leff, P; Williams, M (01 de junio de 1994). "Nomenclatura y clasificación de purinoceptors". Pharmacol Rev 46 (2): 143-156. PMID7938164.
- ^ Mishra N, Tuteja R, Tuteja N (2006). "Señalando a través de redes de cinasa de mapa en las plantas". Arch Biochem Biophys 452 (1): 55 – 68. Doi:10.1016/j.ABB.2006.05.001. PMID16806044.
- ^ Kamenetsky M, Middelhaufe S, Banco E, Levin L, J Buck, Steegborn C (2006). "Detalles moleculares de generación campamento en células mamíferas: un cuento de dos sistemas". J Mol Biol 362 (4): 623 – 39. Doi:10.1016/j.JMB.2006.07.045. PMC3662476. PMID16934836.
- ^ Aplazar Hanoune J, N (2001). Regulación y función de adenylyl cyclase isoformas. Annu Rev Pharmacol Toxicol 41:: 145 – 74. Doi:10.1146/annurev.pharmtox.41.1.145. PMID11264454.
- ^ a b J Stubbe (05 de abril de 1990). "Reductasas ribonucleótido: asombroso y confuso". J Biol Chem 265 (10): 5329 – 32. PMID2180924.
- ^ Chimploy K, Tassotto M, Mathews C (2000). "Reductasa ribonucleótido, un agente posible en las asimetrías de piscina Desoxirribonucleótido inducida por hipoxia". J Biol Chem 275 (50): 39267 – 71. Doi:10.1074/jbc.M006233200. PMID11006282.
- ^ Joyce CM, Steitz TA (1995). "Las estructuras de la polimerasa y la función: variaciones sobre un tema?". J. Bacteriol. 177 (22): 6321 – 9. PMC177480. PMID7592405.
- ^ Eldra P. Solomon, Linda r. Berg, Diana W. Martin. Biología (8ª Ed). ISBN 978-0-495-30978-9
- ^ S Rao, Rossmann M (1973). "Comparación de estructuras secundarias súper en proteínas". J Mol Biol 76 (2): 241 – 56. Doi:10.1016/0022-2836 (73) 90388-4. PMID4737475.
- ^ Scheeff E, Bourne P (2005). "Evolución estructural de la superfamilia de proteínas quinasas-como". PLoS Comput Biol 1 (5): e49. Doi:10.1371/Journal.PCBI.0010049. PMC1261164. PMID16244704.
- ^ Saylor P, C Wang, Hirai T, Adams J (1998). "Un segundo ion del magnesio es crítico para ATP binding en el dominio de la cinasa de la oncoproteína v-Fps". Bioquímica 37 (36): 12624 – 30. Doi:10.1021/bi9812672. PMID9730835.
- ^ Sun Lin X, Ayrapetov M, G (2005). "Caracterización de las interacciones entre el active site de una proteína tirosina quinasa y un activador de metal divalente". BMC Biochem 6:: 25. Doi:10.1186/1471-2091-6-25. PMC1316873. PMID16305747.
- ^ Resetar AM, Chalovich JM (1995). "5'-(gamma-thiotriphosphate) adenosina: un análogo del ATP que debe utilizarse con precaución en los estudios de la contracción muscular". Bioquímica 34 (49): 16039 – 45. Doi:10.1021/bi00049a018. PMID8519760.
Enlaces externos
| Wikimedia Commons tiene medios relacionados con Trifosfato de adenosina. |
- ATP enlazado a proteínas En PDB
- ScienceAid: Energía ATP y ejercicio
- PubChem entrada de trifosfato de adenosina
- Entrada de KEGG para trifosfato de adenosina
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||
Otras Páginas
- Fijacion segura
- Cojinete de ranura espiral
- Nokia Lumia 830 (dispositivos Windows Phone de categoria)
- United Community Bank
- Micro-arrays de espectrometria de masas
- Municipio de Hartley, Union County, Pennsylvania
- Cars (pelicula) (categoria Auto carreras peliculas)
- Thomas D. Clark
- Samsung Galaxy Note II
- Apoyo vital cardiaco avanzado
- Citibank (Malasia) (seccion de Malasia centro de negocios Global de Citi)
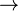 2
2

![\frac{\mathrm{cyt~c_{red}}}{\mathrm{cyt~c_{ox}}} = \left(\frac{[\mathrm{NADH}]}{[\mathrm{NAD}]^{+}}\right)^{\frac{1}{2}}\left(\frac{[\mathrm{ADP}] [P_i]}{[\mathrm{ATP}]}\right)K_{eq}](http://upload.wikimedia.org/math/7/0/6/7064b5fa9828208fd5ee2a3d0d71f04e.png)
