Extracción de acido-base
| Ácidos y bases |
|---|
|
| Ácido tipos de |
|
| Base tipos de |
|
Extracción de acido-base utiliza un procedimiento secuencial extracción líquido – líquido para purificar ácidos y bases de mezclas basados en sus propiedades químicas.[1]
Extracción de la ácido-base se realiza rutinariamente durante la el work-up después de la síntesis químicas y para el aislamiento de compuestos y productos naturales como alcaloides de crudo los extractos de. El producto es en gran parte libre de impurezas neutrales y ácidas o básicas. No es posible separar químicamente similares ácidos o bases usando este sencillo método.
Contenido
- 1 Teoría de la
- 2 Técnica
- 3 Limitaciones
- 4 Alternativas
- 5 Véase también
- 6 Referencias
- 7 Enlaces externos
Teoría de la
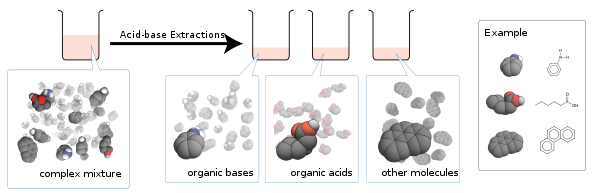
La teoría fundamental detrás de esta técnica es sales, que son iónico, tienden a ser solubles en agua mientras que las moléculas neutrales tienden a no ser.
La adición de un ácido a una mezcla de una base orgánica y ácido dará como resultado el ácido restante sin cargos, mientras que el base estará protonado para formar una sal. Si lo orgánico ácido, tales como una ácido carboxílico, es lo suficientemente fuerte, su uno mismo-ionización puede ser suprimido por el ácido agregado.
Por el contrario, la adición de una base a una mezcla de un ácido orgánico y base resultará en la base restante sin cargos, mientras que el ácido es deprotonated para dar la sal correspondiente. Una vez más, la uno mismo-ionización de una base fuerte es suprimida por la base de añadidos.
El procedimiento de extracción ácido-base puede utilizarse también para separar los ácidos muy débiles de ácidos fuertes y bases muy débiles desde bases más fuertes, mientras que la diferencia de sus pKa (o pKb) constantes es lo suficientemente grande. Por ejemplo:
- Los ácidos muy débiles con los grupos OH fenólicos como fenol, 2-naftol, o 4-hydroxyindole (pKa alrededor de 10) de los ácidos más fuertes como ácido benzoico o ácido sórbico (pKa unos 4-5)
- Bases muy débiles como cafeína o 4-Nitroanilina (pKb unos 13 – 14) de las bases más fuertes como mescalina o dimetiltriptamina (pKb alrededor 3-4)
Generalmente se ajusta el pH a un valor aproximadamente entre el pKa (o pKb) constantes de los compuestos a separar. Ácidos débiles como ácido cítrico, ácido fosfórico, o diluido ácido sulfúrico se utilizan para valores de pH moderadamente ácido, y ácido clorhídrico o ácido sulfúrico concentrado se utiliza para valores de pH fuertemente ácidos. De manera similar, bases débiles como amoniaco o bicarbonato de sodio (NaHCO3) se utilizan para valores de pH moderadamente básica mientras que bases más fuertes como carbonato de potasio (K2CO3) o hidróxido de sodio (NaOH) se utilizan para condiciones fuertemente alcalinas.
Técnica
Generalmente, la mezcla se disuelve en un solvente adecuado como diclorometano o éter dietílico (éter) y vertido en un embudo de separación. Se añade una solución acuosa del ácido o base, y el pH de la fase acuosa se ajusta para traer el compuesto de interés en la forma requerida. Después de la sacudida y permitiendo para separación de fases, la fase que contiene el compuesto de interés se recoge. Luego se repite el procedimiento con esta fase en la gama del pH opuesto. El orden del paso no es importante y el proceso se puede repetir para aumentar la separación. Sin embargo, a menudo es conveniente tener el compuesto disuelto en la fase orgánica después del último paso, para que la evaporación del disolvente produce el producto.
Limitaciones
El procedimiento sólo funciona para ácidos y bases con una gran diferencia en solubilidad entre su carga y su forma sin cargar. El procedimiento no funciona para:
- Zwitterions con ácidos y básicos grupos funcionales en la misma molécula, por ejemplo, Glicina que tienden a ser hidrosoluble a pH más.
- Muy lipófilas aminas que no fácilmente se disuelven en la fase acuosa en su forma cargada, por ejemplo triphenylamine y trihexylamine.
- Ácidos muy lipofílicos que no fácilmente se disuelven en la fase acuosa en su forma cargada, por ejemplo ácidos grasos.
- Menores aminas como amoniaco, metilamina, o trietanolamina que son miscibles o significativamente soluble en agua en pH más.
- Ácidos hidrofílicos como ácido acético, ácido cítricoy la mayoría ácidos inorgánicos como ácido sulfúrico o ácido fosfórico.
Alternativas
Alternativas a la extracción de la ácido-base incluyendo:
- filtrar la mezcla a través de un tapón de gel de sílice o alúmina — cargada de sales tienden a permanecer fuertemente adsorbido a gel de sílice o alúmina
- cromatografía de intercambio iónico puede separar ácidos, bases o mezclas de ácidos fuertes y débiles y las bases por sus afinidades diferentes al medio de la columna a diferente pH.
Véase también
- Cromatografía de, un procedimiento más de gran alcance pero más complejo para separar compuestos
- Extracción
- Líquido de multiphasic
- Embudo de separación
Referencias
- ^ Laurence M. Harwood, Christopher J. Moody (13 de junio de 1989). Química orgánica experimental: principios y práctica (Ilustrado Ed.). WileyBlackwell. págs. 118-22. ISBN978-0-632-02017-1.
Enlaces externos
- Extracción de base ácida
|
||||||||||||||||||||
