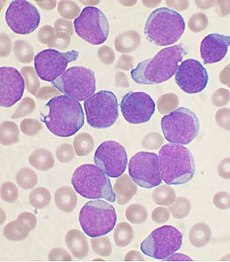
Leucemia linfoblástica aguda
| Leucemia linfoblástica aguda | |
|---|---|
| Clasificación y recursos externos | |
 |
|
| CIE-10 | C91.0 |
| CIE-9 | 204.0 |
| ICD-O: | M9835/3 |
| DiseasesDB | 195 |
| eMedicine | Med/3146 PED/2587 |
| Malla | D054198 |
Leucemia linfoblástica aguda (TODOS) o leucemia linfoide aguda es un agudo forma de leucemia, o cáncer de los glóbulos blancos, caracterizado por la sobreproducción de cancerosos, inmaduro glóbulos blancos— conocido como linfoblastos.[1][2] En personas con todo, los linfoblastos son sobreproducción en la médula ósea y continuamente se multiplican, causando daño y muerte mediante la inhibición de la producción de las células normales, tales como rojo y glóbulos blancos y plaquetas— en la médula ósea y separándose ()la infiltración) a otros órganos. TODO es más frecuente en la infancia con una incidencia máxima en 2 – 5 años de edad y otro pico en la vejez.[2]
Los síntomas de todos son indicativos de una reducción de la producción de células sanguíneas funcionales, porque el leucemia malgastar los recursos de la médula ósea, que normalmente se utilizan para producir células sanguíneas nuevas y funcionamiento.[1][2] Estos síntomas pueden incluir fiebre, aumento del riesgo de infección (especialmente las infecciones bacterianas como neumonía, debido a neutropenia; los síntomas de tal infección incluyen dificultad para respirardolor en el pecho, tos, vómitos, cambios en los hábitos del intestino o vejiga), mayor tendencia al sangrado (debido a trombocitopenia) e indicativo de signos de anemia incluyendo palidez, Taquicardia (frecuencia cardíaca alta), fatiga y dolor de cabeza.[1][2]
Unos 6.000 casos están registrados en el US cada año;[3] estadísticas de otros países son difíciles de conseguir, aunque es conocido por ser más común en la Estados Unidos, Italia y Costa Rica.[2] La cura es una meta realista y se consigue en más del 80% de los niños afectados, aunque sólo 20-40% de los adultos puede ser curado.[1][2] "Aguda" se refiere al curso de la enfermedad para diferenciarla de tiempo relativamente corto leucemia linfocítica crónica, que tiene un curso de tiempo potencial de muchos años.[4][5]
Fue uno de los cánceres primeros para que un tratamiento quimioterapéutico efectivo fue desarrollado como antifolates como aminopterina y metotrexato fueron desarrollados a finales de 1940 por Sidney Farber y Yellapragada Subbarow.[6][7] En este momento un médico no necesita consentimiento un paciente o de los padres para intentar un tratamiento experimental en ellas (como el Código de Nuremberg No había sido firmado en el momento) y al principio intentó ácido fólico suplementos como un tratamiento para todos, que tuvo consecuencias desastrosas — inadvertidamente aceleró las muertes de estos niños.[7]
Contenido
- 1 Signos y síntomas
- 2 Fisiopatología
- 3 Diagnóstico
- 3.1 Citogenética
- 3.2 Clasificación
- 3.2.1 FAB
- 3.2.2 Organización Mundial de la salud
- 3.2.3 Variantes características
- 3.2.4 Inmunofenotipificación
- 4 Tratamiento
- 4.1 Quimioterapia
- 4.2 Terapia de radiación
- 4.3 Terapia biológica
- 4.4 Inmunoterapia
- 5 Pronóstico
- 6 Epidemiología
- 7 Embarazo
- 8 Imágenes adicionales
- 9 Referencias
- 10 Enlaces externos
Signos y síntomas
Inicial síntomas No son específicos para todos, sino empeorar hasta el punto que se busca ayuda médica. Resultan de la falta de células sanguíneas normales y saludables porque ellos se hacinan hacia fuera por los leucocitos (glóbulos blancos) malignos e inmaduros. Por lo tanto, las personas con todos experimentan síntomas de mal funcionamiento de los eritrocitos (glóbulos rojos), leucocitos y plaquetas. Pruebas de laboratorio que pueden mostrar anomalías incluyen pruebas de hemograma, pruebas de función renal, pruebas de electrolitos y las enzimas del hígado.[2]
Los signos y síntomas de todos son variables pero siguen de médula ósea, reemplazo o infiltración del órgano.[2]
- Fatiga y debilidad generalizada
- Anemia
- Mareo
- Frecuentes o inexplicables fiebre y infección
- Pérdida de peso o pérdida del apetito
- Excesiva e inexplicable hematomas
- Dolor óseo, articular dolor (causado por la propagación de las células "ráfaga" a la superficie del hueso o en la articulación de la cavidad de la médula)
- Disnea
- Inflamación de ganglios linfáticos, hígado o bazo
- Las picaduras de edema (hinchazón) en las extremidades inferiores o abdomen
- Petequias, que son pequeñas manchas rojas o líneas en la piel debido a la baja plaqueta niveles de
Fisiopatología

En general, el cáncer es causado por el daño ADN Eso conduce a un crecimiento celular incontrolado y se disemina por todo el cuerpo, aumentando las señales químicas que provocan crecimiento o interrumpiendo las señales químicas que controlan el crecimiento. Daño puede ser causado por la formación de genes de fusión, así como la desregulación de una proto-oncogene mediante la yuxtaposición de lo que el promotor de otro gen, por ejemplo el Receptor de células T Gene. Este daño puede ser causado por factores ambientales tales como productos químicos, drogas o radiación.
TODO está asociado con la exposición a radiación y productos químicos en animales y humanos. Exposición a la radiación de nivel alto es un conocido factor de riesgo para el desarrollo de la leucemia, como las encontradas por los estudios de los sobrevivientes de bomba atómica exposición en Hiroshima y Nagasaki.[8][No en la citación dada] En los animales, la exposición a benceno y otros productos químicos pueden causar leucemia.[citación necesitada] Los estudios epidemiológicos han asociado la leucemia con exposición laboral a agentes químicos, pero estos estudios no son tan concluyentes. Alguna evidencia sugiere que la leucemia secundaria puede desarrollarse en las personas tratadas por otros tipos de cáncer con radiación y quimioterapia debido a que el tratamiento.[9]
Diagnóstico
Diagnóstico TODO comienza con un historial médico, examen físico, conteo sanguíneo completoy manchas de sangre. Porque los síntomas son muy generales, deben excluirse otras enfermedades con síntomas similares. Por lo general, cuanto mayor sea el glóbulo blanco cuenta el peor el pronóstico.[10] Células de la ráfaga se observan en frotis de sangre en la mayoría de los casos (blastocitos son precursores (células madre) a todas las líneas de células inmunitarias). A biopsia de médula ósea es una prueba concluyente de todos.[5] A punción lumbar (también conocido como una punción espinal) le dirá si la columna vertebral y cerebro han sido invadidas.
Patológico examen, citogenética (en particular la presencia de Cromosoma Filadelfia), y Inmunofenotipificación establecer si mieloblástica (neutrófilos, eosinófilos y basófilos) o (linfoblásticaLinfocitos B o Linfocitos T) las células son el problema. Prueba de RNA puede establecer qué tan agresivo es la enfermedad; diversas mutaciones se han asociado con menor o mayor supervivencia. Immunohistochemicaltesting puede revelar TdT o CALLA antígenos en la superficie de las células leucémicas. TdT es una proteína expresada temprano en el desarrollo de células pre-T y pre-B, mientras que CALLA un antígeno se encuentra en un 80% de los casos y también en la "crisis blástica" de CML.
Proyección de imagen médica (tales como ultrasonido o Exploración del CT) puede encontrar invasión de otros órganos comúnmente el pulmón, hígado, bazo, ganglios linfáticos, cerebro, riñones y órganos reproductivos.[4]
Citogenética
Citogenética translocaciones asociado a anormalidades genéticas moleculares específicas en todos
| Desplazamiento citogenético | Anormalidad genética molecular | % |
|---|---|---|
| t(12;21) críptico | TEL-AML1 fusión[11] | 25.4%[12] |
| t(1;19)(q23;p13) | E2A-PBX (PBX1) fusión[13] | 4.8%[12] |
| t(9;22)(q34;q11) | BCR-ABL Fusion(P185)[14] | 1,6%[12] |
| t(4;11)(q21;q23) | MLL-AF4 fusión[15] | 1,6%[12] |
| t | IGH-MYC fusión[16] | |
| t(11;14)(p13;q11) | TCR-RBTN2 fusión[17] |
12; 21 es el desplazamiento más común y augura un buen pronóstico. 4; 11 es la más común en niños menores de 12 meses y augura un pronóstico pobre.[citación necesitada]
Clasificación
Como todo no es un tumor sólido, el TNM notación utilizada en cánceres sólidos es de poca utilidad.
FAB
Subclasificación de las diversas formas de todo solía hacerse según la Clasificación Francés-Americano-Británica (FAB),[18] que fue utilizado para todas las leucemias agudas (incluyendo leucemia mielógena agudaAML).
- ALL-L1: pequeñas células uniformes
- ALL-L2: grandes células variadas
- ALL-L3: grandes células variadas con vacuolas (burbuja-como características)
Cada subtipo más entonces se clasifica mediante la determinación de los marcadores de la superficie de los linfocitos anormales, llamados immunophenotyping. Hay 2 tipos inmunológicos principales: células pre-b y pre-T cell. Las células B maduras todas (L3) ahora se clasifica como Linfoma de Burkitt/Leukemia. Subclasificación ayuda a determinar el pronóstico y el tratamiento más adecuado en el tratamiento de todos.
Organización Mundial de la salud
El panel que internacional reciente sobre todo recomienda que la Clasificación FAB abandonarse, ya que la clasificación morfológica no tiene ninguna importancia clínica o pronóstica. En cambio defiende el uso de la clasificación de immunophenotypic mencionado a continuación.
-
1. agudo leucemia/linfoma linfoblástico. Sinónimos: Ex Fab L1/L2
-
- i. Precursor B leucemia/linfoma linfoblástico agudo. Citogenéticos subtipos:[19]
- t(12;21)(P12,q22) TEL/AML-1
- t(1;19)(q23;p13) PBX/E2A
- t(9;22)(q34;q11) BCR/ABL
- T(V,11)(V;q23) V/MLL
- II. Precursor T leucemia/linfoma linfoblástico agudo
- i. Precursor B leucemia/linfoma linfoblástico agudo. Citogenéticos subtipos:[19]
-
- 2. Leucemia de Burkitt/Lymphoma. Sinónimos: Ex fabulosa L3
- 3. Leucemia aguda biphenotypic
Variantes características
- Leucemia linfoblástica aguda con gránulos citoplasmáticos
- Presentación aplásica de todos
- Leucemia linfoblástica aguda con eosinofilia
- Recaída de la leucemia linfoblástica
- Secundaria todos
Inmunofenotipificación
El uso de un análisis de la TdT y un panel de anticuerpos monoclonales (MoAbs) de células T y células B asociada a antígenos identificará casi todos los casos de todos.
Immunophenotypic categorías de leucemia linfoblástica aguda (ALL)
| Tipos | Clase FAB | TDT | Antígeno asociado t cell | Antígeno asociado de células b | c Ig | s Ig |
|---|---|---|---|---|---|---|
| Precursor B | L1, L2 | + | - | + | -/+ | - |
| Precursor T | L1, L2 | + | + | - | - | - |
| B-cell | L3 | - | - | + | - | + |
Tratamiento
La leucemia linfocítica aguda más temprano se detecta, más eficaz el tratamiento. El objetivo es inducir una duración remisión, definida como la ausencia de células cancerosas detectables en el cuerpo (generalmente menos de 5% células de la ráfaga en la médula ósea).
Puede incluir tratamiento para la leucemia aguda quimioterapia, esteroides, terapia de radiación, intensivo combinado (incluidos los tratamientos médula ósea o célula de vástago trasplantes) y factores de crecimiento.[20]
Quimioterapia
Quimioterapia es el tratamiento inicial de elección. La mayoría de los pacientes recibirán una combinación de diferentes tratamientos. No hay cirugía opciones, debido a la distribución de todo el cuerpo de la células malignas. En general, la quimioterapia citotóxica para todos combina múltiples fármacos antileucémica en varias combinaciones. Quimioterapia para todos consiste en tres fases: terapia de inducción, intensificación y el mantenimiento de la remisión.
| Fase | Descripción | Agentes |
|---|---|---|
| Inducción de la remisión | El objetivo de la inducción de la remisión es matar a la mayoría de las células tumorales rápidamente y entrar al paciente en remisión. Esto se define como la presencia de menos de 5% ráfagas leucémicas en la médula ósea, las células sanguíneas normales y ausencia de células tumorales de sangre y la ausencia de otros signos y síntomas de la enfermedad. Sistema nervioso central Profilaxis (CNS) debe comenzar durante esta fase del tratamiento y continuar durante el período de consolidación e intensificación. La justificación se basa en la presencia de la implicación del CNS en 10% - 40% de pacientes adultos con diagnóstico. | Combinación de Prednisolona o dexametasona, vincristina, asparaginasa (mejor tolerancia en pacientes pediátricos), y daunorrubicina (utilizado en todos los adultos) se utiliza para inducir la remisión. Profilaxis del sistema nervioso central puede lograrse mediante la irradiación, citarabina + metotrexato, o citarabina liposomal.[21] |
| Consolidación e intensificación | Intensificación utiliza altas dosis de quimioterapia multidroga intravenosa para reducir aún más la carga tumoral. Puesto que todas las células a veces penetran el SNC, la mayoría de los protocolos incluyen entrega de quimioterapia en el fluido de CNS (denominado quimioterapia intratecal). Algunos centros de entregan la droga a través de Depósito de Ommaya (un dispositivo quirúrgico colocado debajo del cuero cabelludo y utilizado para administrar medicamentos a los líquidos de CNS y para extraer líquido del CNS para varias pruebas). Otros centros realizarían múltiples punciones lumbares según sea necesario para la entrega de pruebas y tratamiento. | Los protocolos de intensificación típico utilizan vincristina, ciclofosfamida, citarabina, daunorrubicina, etopósido, tioguanina o mercaptopurina dado como bloques en diferentes combinaciones. Para la protección del CNS, metotrexato intratecal o citarabina se utiliza generalmente combinado con o sin irradiación cranio-espinal (el uso de la radioterapia en la cabeza y la espina dorsal). Recaída del sistema nervioso central es tratada con la administración intratecal de hidrocortisona, metotrexato y citarabina. |
| Terapia de mantenimiento | El objetivo de la terapia de mantenimiento es matar cualquier célula residual que no fue asesinado por los regímenes de inducción y la intensificación de la remisión. Aunque tales células son pocos, causarán recaída si no erradicada. | Para este propósito, oral diaria mercaptopurina, una vez semanal oral metotrexato, una vez al mes 5 días curso de anestesia intravenosa vincristina y generalmente se utilizan los corticosteroides orales. La duración de la terapia de mantenimiento es de 3 años para los niños, 2 años para las niñas y los adultos.[22] |
Como el regímenes de quimioterapia puede ser intenso y prolongado (a menudo cerca de 2 años en el caso de los protocolos de GMALL UKALL, HyperCVAD o CALGB; para todos unos 3 años, 2 meses para varones en los protocolos COG; 2 años, 2 meses para las mujeres - más largos para los hombres, como los testículos son una reserva potencial), muchos pacientes tienen una intravenoso catéter insertado en una vena grande (denominado un catéter venoso central o un Línea de Hickman), o un Catéteres, un puerto en forma de cono con una nariz de silicona que es plantado quirúrgicamente bajo la piel, generalmente cerca de la clavícula y el producto más efectivo disponible, debido a riesgos de infección baja y la viabilidad a largo plazo de un catéteres.
Terapia de radiación
Terapia de radiación (o radioterapia) se utiliza en áreas óseas dolorosas, en cargas de alta enfermedad, o como parte de los preparativos para una trasplante de médula ósea (irradiación corporal total). Radiación en forma de radiación de todo el cerebro se utiliza también para la profilaxis del sistema nervioso central, para prevenir la recurrencia de la leucemia en el cerebro. Radiación entero-cerebro profilaxis solía ser un método común en el tratamiento de los niños es todo. Estudios recientes demostraron que la quimioterapia CNS proporciona resultados favorables pero con menos efectos secundarios del desarrollo. Como resultado, el uso de radiación de todo el cerebro ha sido más limitado. Mayoría de los especialistas en leucemia en adultos ha abandonado el uso de la radioterapia para la profilaxis de la CNS, en su lugar usando la quimioterapia intratecal.
Terapia biológica
Para algunos subtipos de todo recayeron, apuntando a objetivos biológicos como el proteasoma, en combinación con quimioterapia, ha dado resultados prometedores en ensayos clínicos.[23] Selección de dianas biológicas sobre la base de sus efectos en los linfoblastos leucémicos combinatorias puede conducir a ensayos clínicos para la mejora de los efectos de todo el tratamiento.[24] En ensayos clínicos en curso, un CD19-CD3 bi-específico anticuerpo monoclonal murino- Blinatumomab, está mostrando gran promesa.
Inmunoterapia
Receptores del antígeno quimérico (Coches) se han desarrollado como una terapia prometedora para todos. Esta tecnología utiliza un fragmento variable de cadena simple (scFv) diseñado para reconocer el marcador de superficie celular CD19 como un método de tratar a todos. CD19 es una molécula que se encuentra en todas las células B y puede ser utilizado como un medio para distinguir la población potencialmente maligna de células B en el paciente. En esta terapia, ratones son inmunizados con antígeno CD19 y producen anticuerpos anti-CD19. Hibridomas desarrollados a partir de las células del bazo del ratón fusionadas a una línea de células de mieloma pueden desarrollarse como una fuente para el cDNA que codifican el anticuerpo específico CD19.[25] Es secuenciado el cDNA y la secuencia de codificación de la variable variable y pesada cadenas ligeras de estos anticuerpos se clonan usando a un enlazador péptido pequeño. Esta secuencia resultante codifica el scFv. Esto puede ser clonado en un transgen de codificación que se convertirá en el endodomain del coche. Existen diferentes arreglos de subunidades utilizados como el endodomain pero consisten generalmente en la región de bisagra que se adhiere a la scFv, una región transmembrana, la región intracelular de una molécula coestimuladoras como CD28 y del dominio intracelular de CD3-zeta que contienen ITAM se repite. Otras secuencias frecuentemente incluidos son: 4-1bb y OX40.[26] La secuencia final del transgén, que contiene las secuencias scFv y endodomain entonces se inserta en las células efectoras inmunes que son obtenidas del paciente y expandidas in vitro. En los ensayos anteriores han sido un tipo de células T capaces de citotoxicidad.[27] Insertar el ADN en la célula efectora puede lograrse mediante varios métodos. Comúnmente, esto se hace utilizando un lentivirus que codifica el transgén. Pseudotyped, Self-inactivadoras lentiviruses han demostrado ser un método eficaz para la inserción estable de un transgen deseada en el ADN genómico de la célula blanco.[28] Otros métodos incluyen electroporación y transfección, pero éstos están limitados en su eficacia como expresión del transgén disminuirá con el tiempo. Luego se trasplantan las células efectoras gen modificado en el paciente. Normalmente este proceso se realiza en conjunción con un regimiento acondicionado como la ciclofosfamida, que se ha demostrado para potenciar los efectos de las células T infundidos. Este efecto se ha atribuido a la creación de un nicho espacial inmunológicas.[26] El proceso en su conjunto resulta en una célula efectora, típicamente un T-cell, que reconoce un antígeno de la célula del tumor de una manera independiente complejo mayor de histocompatibilidad e iniciar una respuesta citotóxica.
Pronóstico
La tasa de supervivencia a 5 años ha mejorado desde cero hace seis décadas, al 85% en la actualidad, en gran parte debido a ensayos clínicos los agentes quimioterapéuticos nuevos y mejoras en trasplante de células madre Tecnología (SCT).[29]
Las tasas de supervivencia de cinco años evaluación los tratamientos más viejos, no corrientes. Nuevos medicamentos y el tratamiento correspondiente a las características genéticas de las células de la ráfaga, pueden mejorar esas tasas. El pronóstico para todo difiere entre los individuos dependiendo de varios factores:[1]
- Género: las mujeres tienden a irles mejor que los varones.
- Origen étnico: Caucásicos son más propensos a desarrollar leucemia aguda que Los afroamericanos, Asiáticos o Hispanos. Sin embargo, también tienden a tener un mejor pronóstico que no-caucásicos.
- Edad al diagnóstico: los niños entre 1 – 10 años de edad son más propensos a desarrollar y a ser curados. Los casos en pacientes de edad avanzada están más probables que el resultado de anomalías cromosómicas (por ejemplo, el cromosoma Filadelfia) que hacen más difícil el tratamiento y pronóstico más pobre.
- Conteo de glóbulos blancos en la diagnosis de menos de 50.000/µl
- Cáncer diseminado en el Sistema nervioso central (cerebro o médula espinal) tiene peores resultados.
- Subtipos morfológicos, inmunológicos y genéticos
- Respuesta del paciente al tratamiento inicial
- Trastornos genéticos tales como El síndrome de Down
Citogenética, el estudio de característicos grandes cambios en la cromosomas de células cancerosas, es un importante predictor de resultados.[30]
Algunos subtipos citogenéticos tienen un pronóstico peor que otros. Estos incluyen:[2]
- Un desplazamiento entre cromosomas 9 y 22, conocido como el Cromosoma Filadelfia, se produce en aproximadamente el 20% de adultos y 5% en los casos pediátricos de todos.
- Una translocación entre los cromosomas 4 y 11 ocurre en aproximadamente el 4% de los casos y es más común en niños menores de 12 meses.
- No todos los desplazamientos de los cromosomas llevan un pronóstico más pobre. Algunos desplazamientos son relativamente favorables. Por ejemplo, Hyperdiploidy (> 50 cromosomas) es un factor de buen pronóstico.
- Cambios genoma copia pueden evaluarse por la citogenética convencional o Cariotipado virtual. SNP Matriz virtual cariotipo puede detectar cambios copia y estatus LOH, mientras que arrayCGH puede detectar solamente copia número cambia. Copia neutral LOH (adquirida disomía uniparental) ha sido reportado en loci claves en todo, como el gen CDKN2A, que tienen significación pronóstica.[31][32][33] Matriz de SNPCariotipado virtual puede detectar fácilmente copiar LOH neutral. Array CGH, peces y citogenética convencional no pueden detectar copiar LOH neutral.
| Cambio citogenético | Categoría de riesgo |
|---|---|
| Cromosoma Filadelfia | Pronóstico pobre |
| t(4;11)(q21;q23) | Pronóstico pobre |
| t(8;14)(q24.1;q32) | Pronóstico pobre |
| Complejo Cariotipo (más de cuatro anomalías) | Pronóstico pobre |
| Baja hypodiploidy o cerca de triploidía | Pronóstico pobre |
| Alta Hyperdiploidy (específicamente, trisomía 4, 10, 17) | Buen pronóstico |
| del(9P) | Buen pronóstico |
Correlación de pronóstico con citogenética encontrando en la leucemia linfoblástica aguda de la médula
| Pronóstico | Resultados citogenéticos |
|---|---|
| Favorable | Hyperdiploidy > 50; t (12; 21) |
| Intermedio | Hyperdiploidy 47 -50; Normal(diploidy); del (6q); Reordenamientos de 8q24 |
| Desfavorable | Hypodiploidy-near haploidía; Cerca de tetraploidy; del (17P); t (9; 22); t (11q23) |
Sin clasificar todo se considera que tienen un pronóstico intermedio.[34]
Epidemiología
En los Estados Unidos, la incidencia de todos es aproximadamente 3000-3500 o aproximadamente 1 en 50.000.[1][2] TODO es ligeramente más común en varones que hembras. En los Estados Unidos en 2010, incidencia en las edades desde el nacimiento hasta 19 fue 38,4 por 1.000.000 por año en los niños y 30.2 por 1.000.000 por año en las niñas.[35] Prevalencia era 30.171, y supervivencia observada era 90% (basado en datos de 2003-2009). TODO tiene una distribución bimodal de la edad, con una alta incidencia en las edades 2 – 5 y otro pico de incidencia por encima de 50 años de edad. Hay una mayor incidencia en personas con Síndrome de Down, Anemia de Fanconi, Síndrome de Bloom, Ataxia-telangiectasia, Agammaglobulinemia X-ligado, y Inmunodeficiencia combinada severa. Hay un mayor riesgo en personas con antecedentes familiares de enfermedades autoinmunes, enfermedades tiroideas autoinmunes particularmente (a saber: Enfermedad de graves o La tiroiditis de Hashimoto).[36]
Embarazo
La leucemia es raramente asociada con el embarazo, afectando sólo aproximadamente 1 de cada 10.000 mujeres embarazadas.[37] Cómo se maneja depende principalmente del tipo de leucemia. Las leucemias agudas normalmente requieren tratamiento rápido y agresivo, a pesar de los riesgos significativos de pérdida del embarazo y defectos de nacimiento, especialmente si la quimioterapia se administra durante el desarrollo sensible primer trimestre.[37]
Es posible, aunque extremadamente rara de leucemia para la difusión de la madre al niño.[38] Esto se llama transmisión vertical.
Imágenes adicionales
-

leucemia linfoblástica aguda (ALL), sangre periférica de un niño, mancha Pappenheim, aumento x 100
-

frotis de médula ósea (gran aumento) de un paciente con leucemia linfoblástica aguda
-

frotis de médula ósea de un paciente con leucemia linfoblástica aguda
Referencias
- ^ a b c d e f Weinblatt, ME (10 de julio de 2013). "Leucemia mielocítica aguda pediátrica". En Sakamoto, KM; Windle, ML; Jesucristo, TP; Arceci, RJ. Medscape Reference. WebMD. 17 de abril de 2014.
- ^ a b c d e f g h i j Seiter, K (05 de febrero de 2014). "La leucemia linfoblástica aguda". En Sarkodee-Adoo, C; Talavera, F; Sacher, RA; Besa, EC. Medscape Reference. WebMD. 17 de abril de 2014.
- ^ Inaba, H; Greaves, M; Mullighan, CG (junio de 2013). "Leucemia linfoblástica aguda". (PDF). The Lancet 381 (9881): 1943 – 55. Doi:10.1016/S0140-6736 (12) 62187-4. PMC3816716. PMID23523389.
- ^ a b Rytting, ME, ed. (noviembre de 2013). "La leucemia aguda". Merck Manual Professional. Merck Sharp & Dohme Corp. 17 de abril de 2014.
- ^ a b Longo, D; Fauci, A; Kasper, D; Hauser, S; Jameson, J; Loscalzo, J (2011). Principios de Harrison de medicina interna (Ed. 18.). Nueva York: McGraw-Hill Professional. ISBN978-0-07174889-6.
- ^ "Evolución de tratamientos contra el cáncer: quimioterapia". Cancer.org. Sociedad Americana del cáncer. 08 de junio de 2012.
- ^ a b Mukherjee, Siddhartha (2010). El emperador de todos los males: una biografía de cáncer (1ª ed. tapa dura Scribner ed.). Nueva York: Scribner. ISBN978-1-4391-0795-9.
- ^ "La leucemia - aguda linfocítica". Sociedad Americana del cáncer. 08 de febrero de 2013.
- ^ Smith, Malcolm A.; et al (febrero de 1999). "La leucemia secundaria o síndrome mielodisplásico después del tratamiento con Epipodophyllotoxins" (PDF). Journal of Clinical Oncology (Sociedad Americana de oncología clínica) 17 (2): 569 – 77. PMID10080601.
- ^ Collier, J.A.B (1991). Oxford Handbook of especialidades clínicas, tercera edición. Oxford. p. 810. ISBN0-19-262116-5.
- ^ Stams WA, den Boer ML, Beverloo HB, et al (abril de 2005). "Los niveles de expresión de TEL, AML1 y los productos de fusión TEL-AML1 y AML1-TEL contra drogas sensibilidad y resultados clínicos en la leucemia linfoblástica aguda pediátrica t(12;21)-positivo". Clin. Cancer Res. 11 (8): 2974 – 80. Doi:10.1158/1078-0432.CCR-04-1829. PMID15837750.
- ^ a b c d Pakakasama S, Kajanachumpol S, Kanjanapongkul S, et al (agosto de 2008). "Simple multiplex RT-PCR para la identificación común transcripciones de la fusión en leucemia aguda infantil". Hematology / Int J Lab 30 (4): 286 – 91. Doi:10.1111/j.1751-553X.2007.00954.x. PMID18665825.
- ^ McWhirter JR, Neuteboom ST, Wancewicz EV, Monia BP, Downing JR, Murre C (septiembre de 1999). "Factor de transcripción homeodomain oncogénico E2A-Pbx1 activa un nuevo gen WNT en leucemia aguda linfoblastoides pre-b". Proc. nacional Acad. Sci U.S.A. 96 (20): 11464 – 9. Doi:10.1073/pnas.96.20.11464. PMC18056. PMID10500199.
- ^ Rudolph C, Hegazy, von Neuhoff N, et al (agosto de 2005). "Caracterización citogenética de una línea celular de BCR-ABL transduced ratón". Cáncer Genet. Cytogenet. 161 (1): 51 – 6. Doi:10.1016/j.cancergencyto.2004.12.021. PMID16080957.
- ^ C Caslini, Serna A, Rossi V, Introna M, Biondi (junio de 2004). "Modulación del ciclo celular por expresión gradual de la oncoproteína de fusión MLL-AF4". Leucemia 18 (6): 1064 – 71. Doi:10.1038/sj.Leu.2403321. PMID14990976.
- ^ Martín-Subero JI, MD Odero, Hernandez R, et al (agosto de 2005). "Amplificación de fusión IGH/MYC en linfomas de centro germinal de células B BCL2, IGH-positivo clínicamente agresivas". Cáncer de los cromosomas de genes 43 (4): 414 – 23. Doi:10.1002/gcc.20187. PMID15852472.
- ^ Zalcberg IQ, Silva ML, Abdelhay E, et al (octubre de 1995). "Desplazamiento 11; 14 de cada tres niños con leucemia linfoblástica aguda de origen T-cell". Cáncer Genet. Cytogenet. 84 (1): 32 – 8. Doi:10.1016/0165-4608 (95) 00062-3. PMID7497440.
- ^ "ACS:: Cómo se clasifica la leucemia linfocítica aguda?".
- ^ "Los avances en la leucemia linfoblástica aguda | Ciencias del laboratorio clínico | Buscar artículos en BNET.com". Ciencias del laboratorio clínico. 2004.
- ^ Leucemia linfoblástica aguda en Hospital Monte Sinaí
- ^ Jabbour, E; Thomas, D; Cortés, J; Kantarjian, HM; O ' Brien, S (15 de mayo de 2010). "Profilaxis del sistema nervioso Central en adultos con leucemia linfoblástica aguda: terapias actuales y emergentes.". Cáncer 116 (10): 2290 – 300. Doi:10.1002/CNCR.25008. PMID20209620.
- ^ Hoffbrand, Victor; Moss, Paul; Pettit, John (31 de octubre de 2006). Hematología esencial. Wiley. ISBN978-1-4051-3649-5. 14 de septiembre de 2013.
- ^ Messinger YH, Gaynon PS, Sposto R, van der Giessen J, Eckroth E, Malvar J, Bostrom A.C.; Avances terapéuticos en infancia leucemia y linfoma (TACL) consorcio. (Julio de 2012). "Bortezomib con quimioterapia es muy activo en la leucemia linfoblástica aguda B-precursor avanzada: avances terapéuticos en infancia leucemia y linfoma (TACL) estudio". Sangre. 120 (2): 285-90. Doi:10.1182/sangre-2012-04-418640. PMID22653976.
- ^ Lambrou GI, Papadimitriou L, Chrousos GP, Vlahopoulos SA. (Enero de 2012). "Impacto de glucocorticoides y proteasoma inhibidor en el linfoblasto leucémica: múltiples, diversas señales convergentes sobre unos reguladores de corriente abajo claves". Mol Cell Endocrinol. 351 (2): 142 – 51. Doi:10.1016/j.MCE.2012.01.003. PMID22273806.
- ^ Grupp, S.A, et al., antígeno quimérico del receptor-modificado las células T para la leucemia linfoide aguda. N Engl J Med, 2013. 368(16): p. 1509-18
- ^ a b Barrett, D.M., et al., terapia del receptor del antígeno quimérico para el cáncer. Annu Rev Med, 2014. 65: p. 333-47
- ^ Alonso-Camino, V., et al., bastidores: anticuerpos humanos contra Cell superficie antígenos tumorales seleccionados de repertorios aparecen en receptores de células T antígeno quimérico. Mol Ther ácidos nucleicos, 2013. 2: p. e93
- ^ Zufferey, R., et al., Self-inactivador vector lentivirus para la entrega segura y eficiente génica in vivo. J Virol, 1998. 72(12): p. 9873-80
- ^ Park, KD (marzo de 2014). "¿Cómo lo elaboramos nosotros mismos para un nuevo paradigma de la medicina para avanzar en el tratamiento de la leucemia linfoblástica aguda pediátrica?" (PDF). Investigación de sangre 49 (1): 3 – 4. Doi:10.5045/br.2014.49.1.3. PMC3974954. PMID24724058.
- ^ Moorman, AV; Harrison, CJ; Buck, GA; Richards, SM; Secker-Walker, LM; Martineau, M; Vance, GH; Cereza, AM; Higgins, RR; Fielding, AK; Foroni, L; Paietta, E; Tallman, MS; Litzow, señor; Wiernik, PH; Rowe, JM; Goldstone, AH; Dewald, GW; Grupo de trabajo de leucemia adulta, investigación médica Consejo/National Cancer Research, Instituto (15 de abril de 2007). "Cariotipo es un factor pronóstico independiente en adultos leucemia linfoblástica aguda (LLA): análisis de datos citogenéticos de los pacientes tratados en el juicio médico investigación Consejo (MRC) UKALLXII/Eastern cooperativa Oncology Group (ECOG) 2993.". Sangre 109 (8): 3189 – 3197. Doi:10.1182/sangre-2006-10-051912. PMID17170120.
- ^ Kawamata, N; Ogawa, S; Zimmermann, M; Kato, M; Sanada, M; Hemminki, K; Yamatomo, G; Nannya, Y; Koehler, R; Flohr, T; Miller, CW; Harbott, J; Ludwig, WD; Stanulla, M; Schrappe, M; Bartram, CR; Koeffler, HP (15 de enero de 2008). "Allelokaryotyping molecular de las leucemias linfoblásticas agudas pediátricas por alta resolución nucleótido polimorfismo del oligonucleótido genómico microarray".. Sangre 111 (2): 776 – 784. Doi:10.1182/sangre-2007-05-088310. PMC2200831. PMID17890455.
- ^ Bungaro, Silvia; Dell ' Orto, Marta Campo; Zangrando, Andrea; Basso, Dario; Gorletta, Tatiana; Lo Nigro, Luca; Leszl, Anna; Young, Bryan D.; Basso, Giuseppe; Bicciato, Silvio; Biondi, Andrea; Te Kronnie, Gertruy; Cazzaniga, Giovanni (01 de enero de 2009). "Integración de genómica y datos de expresión génica de la infancia sin aberraciones conocidas identifican subgrupos con señas de identidad genéticas específicas". Genes, cromosomas y cáncer 48 (1): 22 – 38. Doi:10.1002/gcc.20616. PMID18803328.
- ^ Sulong, S; Moorman, AV; Irving, JA; Strefford, JC; KONN, ZJ; Caso, MC; Minto, L; Barber, KE; Parker, H; Wright, SL; Stewart, AR; Bailey, S; Bown, NP; Hall, AG; Harrison, CJ (01 de enero de 2009). "Un análisis exhaustivo del gen CDKN2A en leucemia linfoblástica aguda infantil revela canceladura genomic, copia número neutral pérdida de heterocigosidad y asociación con subgrupos citogenéticos específicos.". Sangre 113 (1): 100-107. Doi:10.1182/sangre-2008-07-166801. PMID18838613.
- ^ Den Boer ML, van Slegtenhorst M, De Menezes RX, et al (enero de 2009). "Un subtipo de leucemia linfoblástica aguda infantil con resultado pobre del tratamiento: un estudio del genoma clasificación". The Lancet Oncology. 10 (2): 125 – 34. Doi:10.1016/S1470-2045 (08) 70339-5. PMC2707020. PMID19138562.
- ^ Ward, E; DeSantis, C; Robbins, A; Kohler, B; Jemal, un (Mar-Abr 2014). "Niñez y adolescencia cáncer estadísticas, 2014.". CA: un cáncer diario para los médicos 64 (2): 83-103. PMID24488779.
- ^ Florencia Perillat-Menegaux, Jacqueline Clavel, Marie-Françoise Auclerc, André Baruchel, tipo Leverger, Brigitte Nelken, Philippe Noël, Danièle Sommelet, Etienne Vilmer y Denis Hémon (2003). "Historia familiar de leucemia autoinmune enfermedad tiroidea y la infancia". Epidemiología del cáncer, biomarcadores y prevención 12 (1): 60 – 3. PMID12540505. 11 de abril de 2014. "Una asociación estadísticamente significativa entre una historia de enfermedad autoinmune en parientes de primer o segundo grado y todos (OR, 1.7; 95% intervalo de confianza (IC), 1.0 – 2.8) fue encontrado. Una relación entre las enfermedades de la tiroides se observó en general y todo.... Esta asociación fue más pronunciada para las enfermedades tiroideas autoinmunes potencialmente (Grave enfermedad hipertiroidismo Hashimoto enfermedad o como hipotiroidismo) (OR, 3,5; 95% CI, 1.1 – 10.7 y o, 5.6; 95% CI, 1.0 – 31.1, respectivamente para todos y ANLL), mientras que no fue estadísticamente significativa para las demás enfermedades de la tiroides.Los resultados sugieren que una historia familiar de enfermedad de tiroides autoinmune se puede asociar con leucemia aguda infantil".
- ^ a b Shapira T, Pereg D, Lishner M (septiembre de 2008). "Cómo trato a leucemia aguda y crónica en el embarazo". Rev de sangre. 22 (5): 247-59. Doi:10.1016/j.blre.2008.03.006. PMID18472198.
- ^ Isoda T, Ford AM, Tomizawa D, et al (octubre de 2009). "Inmunológicamente silencioso cáncer clon transmisión de madre a hijo". Proc. nacional Acad. Sci U.S.A. 106 (42): 17882 – 5. Doi:10.1073/pnas.0904658106. PMC2764945. PMID19822752.
Enlaces externos
- Leucemia linfoblástica aguda en DMOZ
- Leucemia linfocítica aguda en Sociedad Americana del cáncer
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||


