Cromatografía por exclusión de tamaño

Equipo para correr la cromatografía por exclusión de tamaño. El buffer es bombeado a través de la columna (derecha) por un dispositivo controlado por ordenador
|
|
| Siglas | SEG. |
|---|---|
| Clasificación | Cromatografía de |
| Analitos | macromoléculas polímeros sintéticos biomoléculas |
| Otras técnicas de | |
| Relacionados con la | Cromatografía líquida de alto rendimiento Cromatografía Normal acuosa de la fase Cromatografía de intercambio iónico Cromatografía líquida micelar |
Cromatografía por exclusión de tamaño (SEC) es un cromatográfico método en el cual las moléculas en solución están separadas por su tamaño y en algunos casos peso molecular.[1] Generalmente se aplica a grandes moléculas de o complejos de macromoléculas tales como proteínas y polímeros industriales. Normalmente, cuando una solución acuosa se utiliza para transportar la muestra a través de la columna, la técnica se conoce como cromatografía de gel filtración, versus el nombre cromatografía de permeación de gel, que se utiliza cuando se utiliza un solvente orgánico como una fase móvil. SEC es un ampliamente utilizado caracterización de polímeros método debido a su capacidad para proporcionar buena distribución en masa molar Resultados (Mw) de los polímeros.
Contenido
- 1 Aplicaciones
- 2 Ventajas
- 3 Descubrimiento
- 4 Teoría y método
- 5 Factores que afectan la filtración
- 6 Análisis
- 7 Aplicaciones
- 7.1 Aplicaciones bioquímicas
- 7.2 Síntesis del polímero
- 8 Inconveniente
- 9 Cromatografía por exclusión de tamaño de absoluta
- 10 Véase también
- 11 Referencias
- 12 Enlaces externos
Aplicaciones
La principal aplicación de la cromatografía de gel filtración es la fraccionamiento de proteínas y otros polímeros solubles en agua, mientras que la cromatografía de permeación de gel se utiliza para analizar la distribución del peso molecular de polímeros orgánicos solubles. Cualquier técnica no debe confundirse con electroforesis en gel de, donde se utiliza un campo eléctrico que "tire" o "push" de moléculas a través del gel dependiendo de sus cargas eléctricas.
Ventajas
Las ventajas de este método incluyen buena separación de las moléculas grandes de moléculas pequeñas con un mínimo volumen de eluido,[2] y que pueden aplicarse varias soluciones sin interferir con el proceso de filtración, todo conservando la actividad biológica de las partículas a separar. La técnica se combina generalmente con otros que más moléculas separadas por otras características, tales como acidez, basicidad, carga y afinidad para ciertos compuestos. Con la cromatografía por exclusión de tamaño, hay tiempos cortos y bien definidos de la separación y bandas estrechas, que conducen a la buena sensibilidad. También no hay pérdida de muestra debido a solutos no interactúan con la fase estacionaria. Las desventajas son, por ejemplo, que se puede acomodar sólo un número limitado de bandas debido a la escala de tiempo del cromatograma es corta y, en general, tiene que haber una diferencia de 10% en masa molecular para tener una buena resolución[2]
Descubrimiento
La técnica fue inventada por Grant Henry torno y Colin R Ruthven, trabajando en el Hospital de la reina Charlotte, Londres.[3][4] Más tarde recibieron el John Scott Award para esta invención.[5] Mientras que el torno y Ruthven utilizaron geles de almidón como la matriz, Jerker Porath y Por Flodin más tarde introdujo geles de dextrano;[6] otros geles con propiedades de tamaño fraccionamiento incluyen agarosa y poliacrilamida. Una breve reseña de estos desarrollos ha aparecido.[7]
También hubo intentos de fraccionar polímeros sintéticos de altos; sin embargo, no fue hasta 1964, cuando J. C. Moore de la Dow Chemical Company publicó su trabajo en la preparación de cromatografía de permeación de gel Reticulado de columnas (GPC) basadas en poliestireno con tamaño de poro controlado,[8] que comenzó un rápido incremento de la actividad de investigación en este campo. Se reconoció casi de inmediato que con la calibración adecuada, GPC era capaz de proporcionar la masa molar y distribución en masa molar información de polímeros sintéticos. Debido a la última información era difícil de obtener por otros métodos, GPC rápidamente entró en uso extenso.[9]
Teoría y método
Un requisito para la seg es que el analito no interactúa con la superficie de las fases estacionarias, con diferencias en tiempo de elución analitos idealmente basadas únicamente en el volumen los analitos "ven". Así, una pequeña molécula que puede penetrar en todas las regiones del sistema de poro de la fase estacionaria "ve" un volumen total igual a la suma del volumen entero del poro y el volumen entre partículas. Esta pequeña molécula se procederá a la elución tardía (cuando el volumen del poro y interparticle ha pasado a través de la columna ~ 80% del volumen de columna). En el otro extremo, una molécula muy grande que no puede penetrar en cualquier región del sistema poro "ve" solamente el volumen entre partículas (~ 35% del volumen de columna) y se procederá a la elución anterior cuando este volumen de la fase móvil ha pasado a través de la columna. El principio subyacente de la SEC es que partículas de diferentes tamaños eluir (filtro) a través de una fase estacionaria a distintas velocidades. Esto resulta en la separación de una solución de partículas según tamaño. Siempre que todas las partículas se cargan simultáneamente o cerca-al mismo tiempo, las partículas del mismo tamaño deben eluir juntos.
Sin embargo, como hay varias medida del tamaño de una macromolécula (por ejemplo, la radio de giro y el radio hidrodinámico), un problema fundamental en la teoría de la SEC ha sido la elección de un parámetro de tamaño molecular adecuado por el cual se separan las moléculas de diferentes tipos. Experimentalmente, Benoit y sus colaboradores encontraron una correlación excelente entre volumen de elución y un dinámica basada en tamaño molecular, la volumen hidrodinámico, para varios diferentes composiciones química y arquitectura de la cadena.[10] La correlación observada basándose en el volumen hidrodinámico se convirtió en aceptado como base de calibración universal de seg.
Sin embargo, el uso del volumen hidrodinámico, un tamaño basado en propiedades dinámicas, en la interpretación de los datos de la SEC no se entiende completamente.[11] Esto es porque el SEC se ejecuta normalmente bajo las condiciones de bajo flujo donde factor hidrodinámico debe tener poco efecto en la separación. De hecho, teoría y computadora simulaciones asuman un principio de la separación termodinámico: el proceso de separación está determinada por la distribución de equilibrio (partición) de macromoléculas de soluto entre dos fases---una fase de solución diluida a granel ubicadas en el espacio intersticial y limita las fases de solución dentro de los poros del material de empaque de la columna. Basado en esta teoría, se ha demostrado que el parámetro de tamaño relevante a la compartimentación de los polímeros en los poros es la dimensión de extensión media (media máxima proyección sobre una línea).[12] Aunque esta cuestión no ha sido totalmente resuelta, es probable que la dimensión media de span y el volumen hidrodinámico están fuertemente correlacionados.
Cada columna de exclusión de tamaño tiene una gama de pesos moleculares que pueden ser separados. El límite de exclusión define el peso molecular en el extremo superior de la gama de 'trabajo' de la columna y es donde las moléculas son demasiado grandes para ser atrapado en la fase estacionaria. El extremo inferior de la gama se define por el límite de permeación, que define el peso molecular de las moléculas de una que es pequeño para penetrar todos los poros de la fase estacionaria. Todas las moléculas por debajo de esta masa molecular son tan pequeñas que procederá a la elución como una sola banda[2]

Esto se logra con un aparato llamado una columna, que consiste en un tubo hueco firmemente embalado con los granos de polímero poroso muy pequeños diseñados para tener poros de diferentes tamaños. Estos poros pueden ser depresiones en la superficie o canales a través de la cuenta. Como la solución viaja abajo de la columna algunas partículas entran en los poros. Las partículas más grandes no pueden entrar en tantos poros. Cuanto más grandes las partículas, más rápido la elución.
La solución filtrada se recoge en el extremo se conoce como la eluato. El volumen vacío incluye las partículas demasiado grandes para entrar en el medio, y el volumen de disolvente se conoce como la volumen de la columna.
Factores que afectan la filtración

En situaciones de la vida real, las partículas en solución no tienen un tamaño fijo, dando por resultado la probabilidad que una partícula que lo contrario sería ser obstaculizado por un poro pasando justo por él. También, las partículas de fase estacionaria no se definen idealmente; las partículas y los poros pueden variar en tamaño. Curvas de elución, por lo tanto, se asemejan a Distribuciones Gaussianas. La fase estacionaria también puede interactuar de maneras indeseables con una partícula e influir en tiempos de retención, aunque se tiene mucho cuidado por los fabricantes de columnas con fases estacionarias que son inertes y minimizar este problema.
Como otras formas de cromatografía, aumentando la longitud de la columna mejorará la resolución y aumenta el diámetro de la columna aumenta la capacidad de la columna. Embalaje adecuado de la columna es importante para maximizar la resolución: una columna overpacked puede contraer los poros en los granos, resultando en una pérdida de resolución. Una columna de underpacked puede reducir el área de superficie relativo de la fase estacionaria a especies más pequeñas, dando por resultado las especies pasar menos tiempo atrapado en los poros accesible. A diferencia de técnicas de cromatografía de afinidad, una cabeza de solvente en la parte superior de la columna puede disminuir drásticamente resolución como difunde la muestra antes de cargar, ampliando la elución aguas abajo.
Análisis
En columnas manual simples, el eluyente se recoge en volúmenes constantes, conocidos como fracciones. Cuanto más similares las partículas son de tamaño más probablemente van a estar en la misma fracción y no detectan por separado. Columnas más avanzadas superar este problema constantemente monitoreando el eluyente.
Las fracciones recogidas son a menudo examinadas por técnicas espectroscópicas para determinar la concentración de las partículas que se eluyen. Técnicas de detección de la espectroscopia comunes son Índice de refracción (RI) y ultravioleta (UV). Cuando liberador de especies espectroscópicamente similares (tales como durante la purificación biológica), otras técnicas pueden ser necesarias para identificar el contenido de cada fracción. También es posible analizar el flujo de eluyente continuamente con RI, LALLS, Ángulos múltiples del Laser dispersión de luz Medidas de MALS, UV o viscosidad.

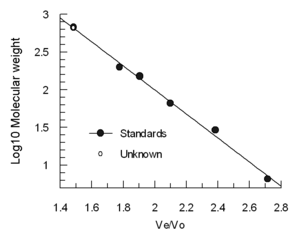
El volumen de elución (Ve) disminuye aproximadamente lineal con la logaritmo El molecular volumen hidrodinámico. Columnas a menudo están calibrados con muestras estándar de 4-5 (por ejemplo, dobladas proteínas de peso molecular conocido) y una muestra que contiene una molécula muy grande como tiroglobulina para determinar la volumen vacío. (Azul dextrano no se recomienda para la determinación de la Vo porque es heterogénea y puede dar resultados variables) Los volúmenes de elución de las normas están divididos por el volumen de elución de la tiroglobulina (Ve/Vo) y conspiraron contra el registro de pesos moleculares de los estándares.
Aplicaciones
Aplicaciones bioquímicas
En general, s se consideran una cromatografía de baja resolución como no distinguir especies similares muy bien y por lo tanto es a menudo reservado para el paso final "pulido" de una purificación. La técnica puede determinar la estructura cuaternaria de las proteínas purificadas que tienen tiempos de intercambio lento, ya que puede llevarse a cabo bajo nativo solución condiciones, preservando interacciones macromoleculares. S también pueden análisis proteína estructura terciaria, como mide el volumen hidrodinámico (no peso molecular), permitiendo plegado y desplegado versiones de la misma proteína que se distinguirá. Por ejemplo, la aparente radio hidrodinámico de una proteína típica de dominio podría ser 14 Å y 36 Å para el plegado y desplegado de las formas, respectivamente. S permite la separación de estas dos formas, la forma doblada será responsables más tarde debido a su tamaño más pequeño.
Síntesis del polímero
SEC se puede utilizar como una medida de ambos el tamaño y la polidispersidad de una síntesis polímero, es decir, la habilidad de ser capaces de encontrar la distribución de los tamaños de las moléculas de polímero. Si van a estándares de un tamaño conocido previamente, y luego un curva de calibración pueden crearse para determinar los tamaños de moléculas de interés en el solvente elegido para el análisis (a menudo THF). De manera alternativa, técnicas tales como la luz dispersión o viscometry puede utilizarse en línea con SEC para rendir absolutas pesos moleculares que no dependen de la calibración con estándares de peso molecular conocido. Debido a la diferencia de tamaño de dos polímeros con pesos moleculares idénticos, los métodos de determinación absoluta son, en general, más deseable. Un sistema típico de la SEC puede rápidamente (en aproximadamente media hora) dar a químicos polímeros información sobre el tamaño y la polidispersidad de la muestra. La SEC preparativa puede ser utilizada para fraccionamiento de polímeros en una balanza analítica.
Inconveniente
En el SEC, masa no mide tanto como el volumen hidrodinámico de las moléculas del polímero, es decir, cuánto espacio ocupa una molécula de polímero particular cuando está en solución. Sin embargo, se puede calcular el peso molecular aproximado de datos SEC ya que puede encontrarse la relación exacta entre peso molecular y volumen hidrodinámico para el poliestireno. Para ello, poliestireno se utiliza como un estándar. Pero la relación entre el peso molecular y volumen hidrodinámico no es el mismo para todos los polímeros, tan sólo una medida aproximada puede obtenerse.[13] Otro inconveniente es la posibilidad de interacción entre la fase estacionaria y el analito. Cualquier interacción conduce a un tiempo de elución más adelante y así imita una talla más pequeña de analito.
Cromatografía por exclusión de tamaño de absoluta
Cromatografía de exclusión de tamaño absoluto (ASEC) es una técnica que una dispersión ligera dinámica (DLS) instrumento a un sistema de cromatografía exclusión de tamaño para la medición del tamaño absoluto de proteínas y macromoléculas responsables del sistema de cromatografía.
La definición de absoluto aquí es que no requiere calibración para obtener tamaño hidrodinámico, referido a menudo como diámetro hidrodinámico (DH en unidades de nm). Los tamaños de las macromoléculas se miden como procederá a la elución en la célula de flujo del instrumento DLS desde el conjunto de columna de exclusión de tamaño. Cabe señalar que el tamaño hidrodinámico de las partículas o moléculas se miden y no sus pesos moleculares. Para las proteínas de un tipo de Mark-Houwink de cálculo puede utilizarse para estimar el peso molecular del tamaño hidrodinámico.
Una gran ventaja de DLS juntada con SEC es la capacidad para obtener mayor resolución DLS[citación necesitada]. Lote DLS es rápida y sencilla y proporciona que una medida directa del tamaño promedio, pero la resolución de referencia de DLS es de 3 a 1 de diámetro. Con el SEC, las proteínas y oligómeros de proteína se separan, permitiendo la resolución de los. Estudios de agregación también se pueden hacer con ASEC aunque no puede calcularse la concentración agregada, se medirá el tamaño del agregado para ser limitado por el liberador de tamaño máximo de las columnas de la SEC.
Limitaciones de ASEC incluyen caudal, concentración y precisión. Debido a una función de correlación requiere en cualquier lugar de 3 – 7 segundos a construir correctamente, un número limitado de puntos de datos puede recogerse a través de la cima.
Véase también
- Pegilación
- Cromatografía de permeación de gel
Referencias
- ^ Paul-Dauphin, Stephanie; Morgan, Millan-Agorio, Herodes, Kandiyoti (06 de octubre de 2007). "Mecanismos de exclusión de tamaño de mezclas complejas de hidrocarburos de sondeo: el efecto de alterar las composiciones de eluyente". Energía y combustibles. 6 21 (6): 3484-3489. doi:10.1021/ef700410e. 6 de octubre, 2007.
- ^ a b c Skoog, D. A.; Principios de Análisis Instrumental, 6ª ed.; Thompson Brooks/Cole: Belmont, CA, 2006, capítulo 28.
- ^ Torno, GH y Ruthven, CR (1955) la separación de sustancias en función de sus pesos moleculares, utilizando columnas de almidón y agua. BIOCHEM J. 4: xxxiv.
- ^ Torno, GH y Ruthven, CR (1956) la separación de sustancias y la estimación de sus tamaños moleculares relativos mediante el uso de columnas de almidón en agua. Biochem. J. 62(4): 665-674. artículo
- ^ Premio de John Scott
- ^ J, Porath y Flodin, filtración de Gel P (1959): un método para la desalación y la separación del grupo. Naturaleza 183(4676): 1657-1659.
- ^ Eisenstein, M (2006) una mirada hacia atrás, aventuras en la matriz. 3 métodos de naturaleza: 410 artículo
- ^ Moore, J. C. (1964) cromatografía de permeación de Gel. 1. un nuevo método para la distribución de peso Molecular de polímeros altos. Diario de la ciencia de los polímeros: parte 2: 835-843 [1]
- ^ Striegel, A. M.; Kirkland, j. j.; Yau, W. W.; Bly, D. D.; Moderna cromatografía por exclusión de tamaño, práctica de la impregnación del Gel y cromatografía de Gel filtración, 2 ª ed.; Wiley: Nueva York, 2009.
- ^ Grubisic, Z.; Rempp, P.; Benoit, H. (1967) A universal calibración de cromatografía de permeación de Gel. Diario de la ciencia de los polímeros: polímeros. Lett. 5: 753-759
- ^ Sol, T.; Oportunidad, r. r.; Graessley, W. W.; y Lohse, D. J. (2004) un estudio del principio de la separación en cromatografía por exclusión de tamaño. Macromoléculas 37:4304-4312.
- ^ Wang, Y.; Teraoka, I.; Hansen, F. Y.; Peters, G. H.; y Hassager, O. (2010) un estudio teórico del principio de separación en cromatografía por exclusión de tamaño. Macromolécula 43:1651-1659.
- ^ Polímero Science Learning Center (PSLC) - cromatografía por exclusión de tamaño
|
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||
Enlaces externos
| Recursos de la biblioteca Acerca de Cromatografía de permeación de gel |
|
- [2], Tamaño de exclusión cromatografía principios y métodos manual de GE Healthcare Life Sciences.